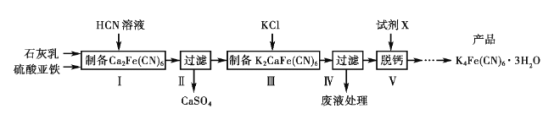
题目内容
【题目】某溶液A中可能只含有K+、Fe3+、Cu2+、Fe2+、Ag+、Mg2+、Al3+、NH4+、Cl-、NO3-、SO42-中的若干种,为检验确认其中所含的各离子,取1L溶液A,进行如下实验:

已知气体A、B的体积都为2.24L(标况下),沉淀B的物质的量为0.1mol,根据以上实验操作与现象,有关于该溶液的结论正确的是:
A.溶液A中肯定存在Fe2+、Ag+、Mg2+、NO3-
B.溶液A中一定不含Al3+
C.溶液A中可能含有Cu2+、Cl-
D.溶液A中c(NO3-)≥1.0mol/L
【答案】D
【解析】
加入稀硝酸后产生气体A,说明溶液中含Fe2+,则生成的气体A为NO,且物质的量为0.1mol,根据得失电子数守恒可知Fe2+的物质的量为0.3mol;在溶液B中加入过量的Ba(OH)2,产生气体B为0.1mol,则说明溶液中含NH4+,且物质的量为0.1mol;所得的溶液C中可能含K+,[Cu(NH3)4]2+,[Ag(NH3)2]+和AlO2,加入足量的HBr,生成沉淀B,则沉淀B为AgBr,由于沉淀AgBr的物质的量为0.1mol,故原溶液中含Ag+,且物质的量为0.1mol,溶液中存在Ag+,而0.1molAg+转化为[Ag(NH3)2]+消耗NH30.2mol;由于Ag+的存在,则溶液中不能含Cl和SO42-,但由于溶液要呈电中性,故溶液中一定存在NO3-;溶液中可能存在的Cu2+和Al3+会进入溶液D,但Cu2+和Al3+的存在不能确定;故所得的沉淀A可能为Fe(OH)3和Mg(OH)2或两者之一。故溶液中一定含:Fe2+ NH4+,Ag+, NO3-;一定不存在:Cl和SO42-;可能存在:K+和Fe3+,Al3+,Cu2+,Mg2+中的一种或几种。由于溶液中的Fe2+的物质的量为0.3mol,生成的NH3的物质的量为0.1mol,而0.1molAg+转化为[Ag(NH3)2]+消耗NH30.2mol,故溶液中NH4+共0.3mol;Ag+的物质的量为0.1mol,设溶液中的NO3-的物质的量为xmol,由于溶液中除了Fe2+、NH4+、Ag+,还可能含有其他的阳离子,故有:X0.3mol×2+0.3mol+0.1mol=1mol。
A. 溶液中Mg2+的存在不能确定,故A错误;
B.Al3+的存在不能确定,故B错误;
C. 溶液A中无Cl,故C错误;
D. 溶液中的Fe2+的物质的量为0.3mol;由于生成的NH3的物质的量为0.1mol,而0.1molAg+转化为[Ag(NH3)2]+消耗NH30.2mol,故溶液中NH4+共0.3mol;Ag+的物质的量为0.1mol,设溶液中的NO3-的物质的量为xmol,由于溶液中除了Fe2+, NH4+,Ag+,还可能含有其他的阳离子,根据溶液电中性,故有:X0.3mol×2+0.3mol+0.1mol=1mol,则c(NO3-)=n/V1mol/1L=1mol/L,故D正确,故选:D。

【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。