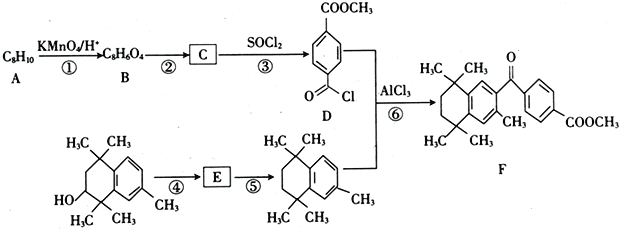
题目内容
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g)![]() 2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
(2)乙醇水蒸气重整制氢
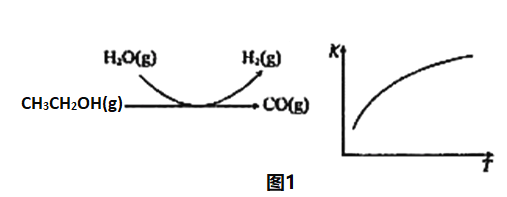
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1molH2(g),热量变化是62kJ,则该反应的热化学方程式为_____________。
(3)水煤气法制氢
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。

①向2L恒温恒容密闭容器中加入一定量的CO和0.1molH2O(g),在图中G点对应温度下,反应经5min达到平衡,则平均反应速率v(CO)=________。
②图中B、E两点对应的反应温度分别为TB和TE,则TB_____TE(填“>”“<”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和x molH2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
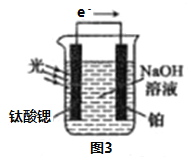
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
【答案】  CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g)△H=+248kJ/mol 0.006mol·L-l·min-1 > 化学平衡常数(或K) 0≤x<3 2H2O+2e-=H2↑+2OH-
4H2(g)+2CO(g)△H=+248kJ/mol 0.006mol·L-l·min-1 > 化学平衡常数(或K) 0≤x<3 2H2O+2e-=H2↑+2OH- ![]()
【解析】(1)反应的平衡常数为生成浓度的系数次方相乘,再除以反应物浓度的系数次方相乘,所以表达式为:  。
。
(2)由图1所示,随温度升高,反应的K值增大,说明该反应为吸热反应。图示方程式为:CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g),每生成1molH2(g),热量变化(吸热)是62kJ,所以热化学方程式为:CH3CH2OH(g)+H2O(g)
4H2(g)+2CO(g),每生成1molH2(g),热量变化(吸热)是62kJ,所以热化学方程式为:CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g)△H=+248kJ/mol
4H2(g)+2CO(g)△H=+248kJ/mol
(3)①图中G点的n(CO):n(H2O)=1.5,所以加入的CO为0.15mol,达平衡时,CO的转化率为40%,所以反应的CO为0.06mol,除以容器体积和反应时间,得到v(CO)= 0.006mol·L-l·min-1。
②如果B、E同温,则B→E的过程中,随着n(CO):n(H2O)由0.5变为1,则CO的转化率应该降低,但是B、E两点的转化率相等,说明温度的变化使E的转化率升高了,所以由B→E应该是降温(反应放热,降温平衡正向移动),即TB>TE。
③以G点为例,n(CO):n(H2O)=1.5,CO的转化率为40%,有以下计算结果:
CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始: 3 2 0 0
反应: 1.2 1.2 1.2 1.2
平衡: 1.8 0.8 1.2 1.2
所以反应的K=(1.2×1.2)÷(1.8×0.8)=1。重复如上计算,可以得到A点和E点的平衡常数也是1,所以三点的温度相同。
④由③的计算结果,该温度下平衡常数为1,按照题目的量加入容器,反应的Q值为:(1×x)÷(1×3)=x/3,为保证平衡正向移动,要求Q小于K,所以x/3<1,即x<3,反应为:0≤x<3。
(4)由图示在Pt电极上应该发生得电子的还原反应,溶液中也只可能是水电离的氢离子得电子,所以方程式为:2H2O+2e-=H2↑+2OH-。
(5)350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物,因为Mg2Cu→MgCu2的过程中Mg:Cu在减小,所以生成的含一种金属元素的氢化物一定是Mg的氢化物。设该氢化物为MgHX,有x/(24+x)=7.7%,所以x=2。由上,方程式为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:
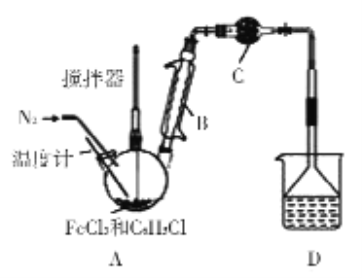
(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________