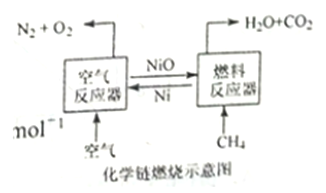
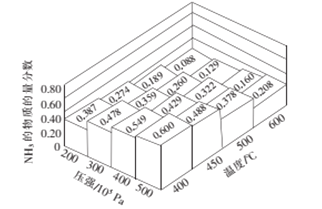
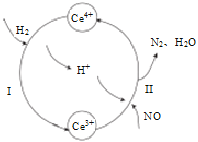
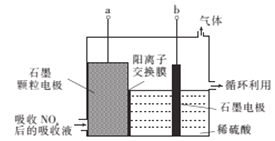
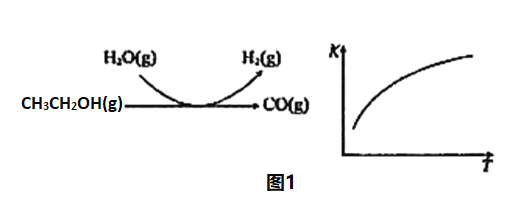
题目内容
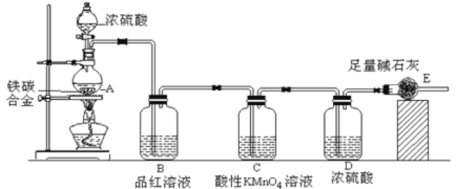
【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________
【答案】 球形冷凝管 AC 将HCl气体全部吹入到C装置中,使其被充分吸收 滴入最后一滴标准液时,生成砖红色沉淀且半分钟不溶解 20.16% 乙醚 蒸馏
【解析】(1)仪器B的名称球形冷凝管
(2)由2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl知仪器C是干燥HCl的,又是球形干燥管,所以不能装浓统酸,也不能装碱石灰,碱石灰能和HCl反应,所以可装无水氯化钙或五氧化二磷。答案:AC。
2FeCl2+C6H4Cl2+HCl知仪器C是干燥HCl的,又是球形干燥管,所以不能装浓统酸,也不能装碱石灰,碱石灰能和HCl反应,所以可装无水氯化钙或五氧化二磷。答案:AC。
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收 。
(4)滴定终点的现象是滴入最后一滴标准液时,生成砖红色沉淀且半分钟不溶解。
由2FeC:l3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl Ag++Cl-= AgCl
2FeCl2+C6H4Cl2+HCl Ag++Cl-= AgCl![]() 。所以2FeCl3
。所以2FeCl3![]() AgNO3。根据消耗AgNO3的物质的量为0.002520L
AgNO3。根据消耗AgNO3的物质的量为0.002520L![]() 0.1000mol/L
0.1000mol/L![]() 100/25=0.001008 mol,所以反应的FeCl3的质量为m=0.001008 mol
100/25=0.001008 mol,所以反应的FeCl3的质量为m=0.001008 mol![]() 2
2![]() 162.5 g/ mol=1.638g,氯化佚的转化率是1.638g/16.25 g
162.5 g/ mol=1.638g,氯化佚的转化率是1.638g/16.25 g![]() 100%=20.16%.答案:滴入最后一滴标准液时,生成砖红色沉淀且半分钟不溶解 20.16% 。
100%=20.16%.答案:滴入最后一滴标准液时,生成砖红色沉淀且半分钟不溶解 20.16% 。
(5)因为C6H4Cl2不溶于水,易溶于乙醚,所以洗涤所用最佳试剂是乙醚;因为C6H4Cl2和C6H5Cl都是易溶于乙醚的物质,但他们的沸点不同,C6H4Cl2的沸点为173℃,C6H5Cl的沸点为132℃,所以可以利用蒸馏的方法回收滤液中C6H5Cl。

【题目】我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________。
(2)根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:_______。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____,N的杂化方式为________,写出NH3的一种等电子体___________。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.NaB.PoC.MgD.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏加德罗常数用NA表示,则Cr的原子半径是__pm.(写出表达式即可)