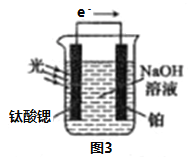
题目内容
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
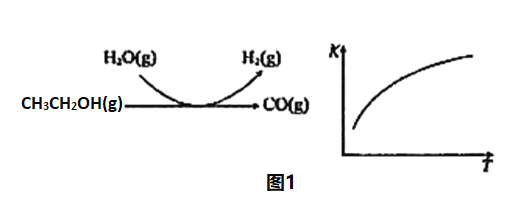
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

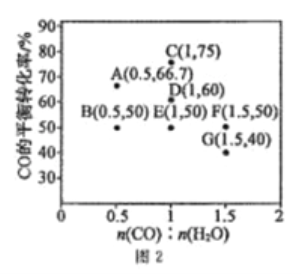
(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
【答案】 B 反应i为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大 9:5 减小 升高温度。反应i中CO的物质的量增大。反应ii中CO的物质的量增大、CO2的物质的量减小,最终n(CO2)/(CO)的值减小 P1>P2>P3 0.875
【解析】(1)反应iCH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大,B曲线正确;由图1可知,T1℃时,CH3OH(g)的平衡转化率为40%,则平衡体系中CH3OH(g)、CO(g)、H2的物质的量分别为0.6mol、0.4mol、0.8mol,同温同体积下,压强比等于气体物质的量之比,则体系的平衡压强与起始压强之比为1.8:1=9:5;(2) ①反应i为吸热反应,升高温度,平衡正向移动,CO的物质的量增大,反应ii为放热反应,升高温度,平衡逆向移动,CO的物质的量增大,CO2的物质的量减小,故温度升高,n(CO2)/n(CO)的值减小;②反应i为气体分子总数增大的反应,增大压强,CO的体积分数减小,反应ii为气体分子总数相等的反应,压强不影响平衡,增大压强,CO的体积分数不变,综上所述,增大压强,CO的体积分数减小,故P1>P2>P3;③设反应i中参加反应的CH3OH(g)的物质的量为x,则生成的CO的物质的量为x,应用差量法,反应i中气体总物质的量增大2x,反应ii中气体总物质的量不变,故平衡时容器内气体总物质的量为(2+2x)mol;体系中CO2的物质的量为0.2mol,则消耗CO的物质的量为,则平衡时CO的物质的量为(x-0.2)mol,结合图2得
CO(g)+2H2 △H =+90kJ·mol-1为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大,B曲线正确;由图1可知,T1℃时,CH3OH(g)的平衡转化率为40%,则平衡体系中CH3OH(g)、CO(g)、H2的物质的量分别为0.6mol、0.4mol、0.8mol,同温同体积下,压强比等于气体物质的量之比,则体系的平衡压强与起始压强之比为1.8:1=9:5;(2) ①反应i为吸热反应,升高温度,平衡正向移动,CO的物质的量增大,反应ii为放热反应,升高温度,平衡逆向移动,CO的物质的量增大,CO2的物质的量减小,故温度升高,n(CO2)/n(CO)的值减小;②反应i为气体分子总数增大的反应,增大压强,CO的体积分数减小,反应ii为气体分子总数相等的反应,压强不影响平衡,增大压强,CO的体积分数不变,综上所述,增大压强,CO的体积分数减小,故P1>P2>P3;③设反应i中参加反应的CH3OH(g)的物质的量为x,则生成的CO的物质的量为x,应用差量法,反应i中气体总物质的量增大2x,反应ii中气体总物质的量不变,故平衡时容器内气体总物质的量为(2+2x)mol;体系中CO2的物质的量为0.2mol,则消耗CO的物质的量为,则平衡时CO的物质的量为(x-0.2)mol,结合图2得![]() ,解得,则反应ii的平衡常数
,解得,则反应ii的平衡常数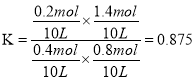 。
。

 名校课堂系列答案
名校课堂系列答案【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
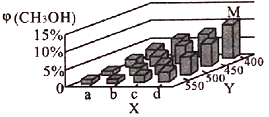
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
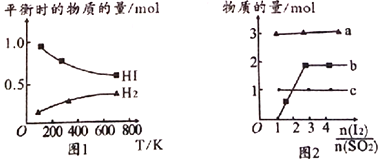
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。