题目内容
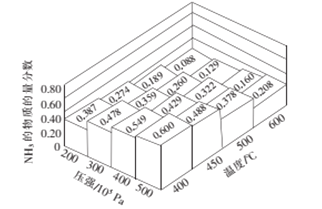
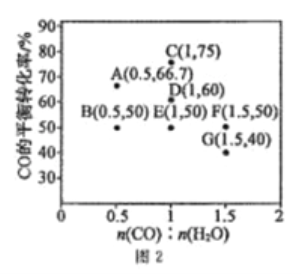
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
【答案】B
【解析】分析:A项,由NH3·H2O的分布分数的变化分析NH4+的分布分数的变化,再结合图像判断当pH=9时,溶液中各离子浓度大小;B项,根据碳酸氢铵溶液pH=7.8,判断NH4+与HCO3-的大小关系,结合物料守恒解决该项;C项,结合图像判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;D项,利用图像中的特殊点(如pH=6.5时)对应的离子浓度,计算水解平衡常数Kh(HCO3-)。
详解:A项,由图像可得,pH=9时,溶液中c(HCO3-)>c(NH3·H2O)>c(CO32-),又因为含氮微粒为NH4+和NH3·H2O,所以NH4+和NH3·H2O的分布分数之和应等于1,所以当pH=9时,溶液中存在关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故A错误;B项,根据物料守恒,NH4HCO3溶液中存在:①c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-),又因为0.1mol·L-1NH4HCO3溶液,pH=7.8,所以Kh(NH4+)<Kh(HCO3-),因此c(NH4+)>c(HCO3-),再结合①式可得:c(NH3·H2O)<c(H2CO3)+c(CO32-),即![]() <1,故B正确;C项,根据图像可知,当溶液pH增大时,NH3·H2O浓度逐渐增大,则NH4+的浓度逐渐减小,而HCO3-浓度先增大后减小,故C错误;D项,Kh(HCO3-)=
<1,故B正确;C项,根据图像可知,当溶液pH增大时,NH3·H2O浓度逐渐增大,则NH4+的浓度逐渐减小,而HCO3-浓度先增大后减小,故C错误;D项,Kh(HCO3-)=![]() ,如图常温下当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=Kw/c(H+)=10-14/10-6.5=10-7.5=
,如图常温下当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=Kw/c(H+)=10-14/10-6.5=10-7.5=![]() ×10-8,将数据代入上式得:Kh(HCO3-)=
×10-8,将数据代入上式得:Kh(HCO3-)=![]() ×10-8,常温下水解平衡常数Kh(HCO3-)的数量级为10-8,故D错误。综上分析,符合题意的选项为B。
×10-8,常温下水解平衡常数Kh(HCO3-)的数量级为10-8,故D错误。综上分析,符合题意的选项为B。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
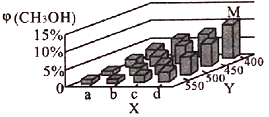
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
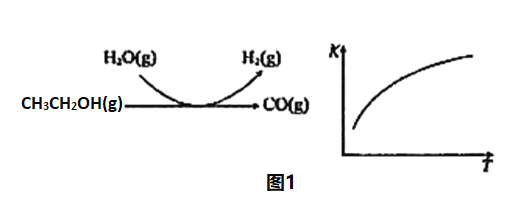
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
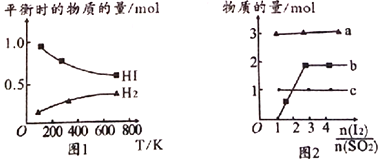
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
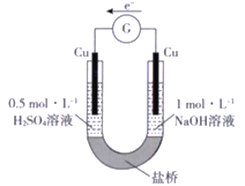
【题目】研究小组进行如下表所示的原电池实验:
实验编号 | ① | ② |
实验装置 |
|
|
实验现象 | 连接装置5 分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 左侧铁片表面持续产生气泡,连接装置5 分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A. 两装置的盐桥中,阳离子均向右侧移动
B. 实验①中,左侧的铜被腐蚀
C. 实验②中,左侧电极的电极反应式为2H++ 2e-=H2↑
D. 实验① 和实验②中,均有O2 得电子的反应发生