题目内容
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
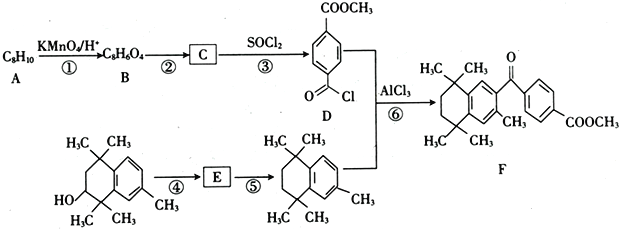
已知:Ⅰ. 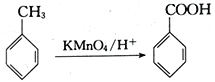
Ⅱ. 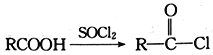
回答下列问题:
(1)B的名称是____________________。
(2)反应②和⑤所属的反应类型分别为____________、_____________。
(3)反应④所需的条件为___________,E分子中官能团的名称为_________________。
(4)反应⑥的化学方程式为________________________________。
(5)芳香族化合物X是C的同分异构体,X只含一种官能团且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,则X的结构有__________种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为____________、_____________。
【答案】 )对苯二甲酸 取代反应(或酯化反应) 加成反应 浓硫酸、加热 碳碳双键 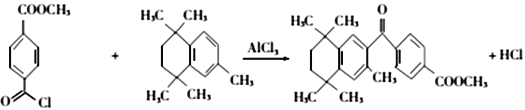 10
10 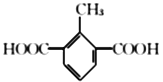
【解析】(1)根据合成流程可知,A被酸性高锰酸钾溶液氧化生成对苯二甲酸,则A为对二甲苯, B为对苯二甲酸;正确答案:对苯二甲酸。
(2)根据对苯二甲酸和D的结构简式可以知道C为![]() ,所以由B到C的反应为酯化反应;对比B与反应(5)的产物结构可以知道,B发生消去反应生成E为
,所以由B到C的反应为酯化反应;对比B与反应(5)的产物结构可以知道,B发生消去反应生成E为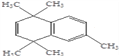 ,反应⑥是E与
,反应⑥是E与![]() 发生加成反应;正确答案:取代反应(或酯化反应); 加成反应。
发生加成反应;正确答案:取代反应(或酯化反应); 加成反应。
(3)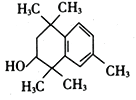 在浓硫酸加热作用下,醇发生消去反应生成E,结构简式为:
在浓硫酸加热作用下,醇发生消去反应生成E,结构简式为: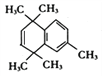 ;分子中含有官能团碳碳双键;正确答案:浓硫酸、加热;碳碳双键。
;分子中含有官能团碳碳双键;正确答案:浓硫酸、加热;碳碳双键。
(4)有机物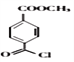 与有机物
与有机物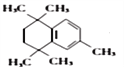 在氯化铝的作用下发生取代反应,化学方程式为:
在氯化铝的作用下发生取代反应,化学方程式为: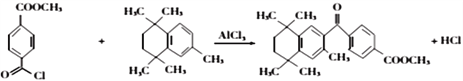 ;正确答案:
;正确答案: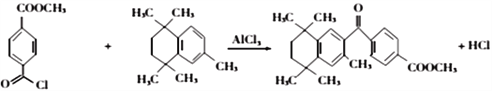 。
。
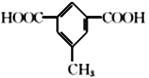
(5)有机物C为![]() ,芳香族化合物X只含一种官能团,且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,结构中含有2个羧基,满足这样条件的有机物结构有:2个-COOH、1个-CH3分别连在苯环上,结构有6种;1个–COOH、1个-CH2COOH分别连在苯环上,结构有3种;苯环上连有
,芳香族化合物X只含一种官能团,且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,结构中含有2个羧基,满足这样条件的有机物结构有:2个-COOH、1个-CH3分别连在苯环上,结构有6种;1个–COOH、1个-CH2COOH分别连在苯环上,结构有3种;苯环上连有![]() 的结构有1种;共计有10种;其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为
的结构有1种;共计有10种;其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为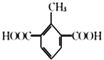 和
和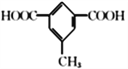 ;正确答案:10;
;正确答案:10; 和
和 。
。