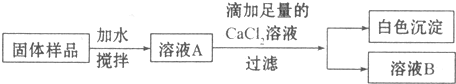
题目内容
1.下列有关说法正确的是( )| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
分析 A.漂白粉久置于空气中,与水、二氧化碳反应而变质;
B.海水中含NaCl、镁离子、溴离子等;
C.用氧化物表示组成,原子应守恒;
D.二氧化硅与HF酸反应,与常见的盐酸、硫酸、硝酸不反应.
解答 解:A.漂白粉久置于空气中,发生Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,变质后漂白效果变差,故A错误;
B.海水中含NaCl、镁离子、溴离子等,电解食盐水可得到氢气、氯气,可制备HCl,电解熔融NaCl可冶炼Na,电解熔融氯化镁冶炼Mg,发生氧化还原反应提取Br2,故B正确;
C.用氧化物表示组成,原子应守恒,则蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•H2O,故C错误;
D.二氧化硅与常见的盐酸、硫酸、硝酸不反应,可用石英制造耐酸容器,但二氧化硅与HF酸反应,故D错误;
故选B.
点评 本题考查物质的性质,为高频考点,把握常见单质和化合物的性质为解答的关键,综合考查元素化合物知识,题目难度不大,注意海水资源的综合应用.

练习册系列答案
相关题目
11.在100mL混合溶液中,硝酸和硫酸的物质的量浓度分別是0.4mol•L-1、0.1mol•L-1,向混合溶液中加入1.92g铜粉,并加热,待充分反应后,所得溶液中Cu2+物质的量浓度是(假设反应前后溶液体积不变)( )
| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |
9.下列化学用语正确的是( )
| A. | 乙烯的结构简式是C2H4 | |
| B. | 氯离子的结构示意图: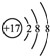 | |
| C. | NaCl的电子式是Na:Cl | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
16.下列制取氢气的方法中,反应速率最小的是( )
| A. | 10℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| B. | 50℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| C. | 10℃时,块状锌与3 mol/L硫酸溶液反应 | |
| D. | 50℃时,块状锌与3 mol/L硫酸溶液反应 |
6.下列物质只含有离子键的是( )
| A. | CO2 | B. | CaCl2 | C. | NH4Cl | D. | NaOH |
13.在含有较多NH4+、Ba2+、NO3ˉ、Clˉ的溶液中还能大量共存的离子是( )
| A. | Ag+ | B. | H+ | C. | SO42ˉ | D. | OHˉ |
10.下列图示实验正确的是( )
| A. | 测量Cu与浓硝酸反应产生气体的体积: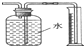 | |
| B. | 验证Na和水反应为放热反应: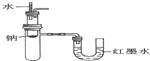 | |
| C. | 制取干燥的氨气: | |
| D. | 收集H2 |