题目内容
9.下列化学用语正确的是( )| A. | 乙烯的结构简式是C2H4 | |
| B. | 氯离子的结构示意图: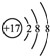 | |
| C. | NaCl的电子式是Na:Cl | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
分析 A.乙烯的结构简式中需要标出其官能团碳碳双键;
B.氯离子的核电荷数为17,最外层达到8电子稳定结构;
C.氯化钠为离子化合物,电子式中需要标出所带电荷;
D.硫酸为强电解质,在溶液中完全电离出氢离子和硫酸根离子,氢离子不能合并.
解答 解:A.乙烯中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故A错误;
B.氯原子的核电荷数为17,核外电子总数都是118,其离子结构示意图为: ,故B正确;
,故B正确;
C.氯化钠属于离子化合物,钠离子用化学式表示,氯离子需要标出所带电荷及最外层电子,氯化钠正确的电子式为: ,故C错误;
,故C错误;
D.硫酸在溶液中完全电离出氢离子和硫酸根离子,其正确的电离方程式为:H2SO4═2H++SO42-,故D错误;
故选B.
点评 本题考查了原子结构示意图、结构简式、电子式、电离方程式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确结构简式与分子式、离子化合物与共价化合物的电子式的区别.

练习册系列答案
相关题目
19.在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?TCO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A. | 正反应为吸热反应 | |
| B. | 实验1中,CO的转化率为80% | |
| C. | 650℃时,化学平衡常数K=$\frac{8}{3}$ | |
| D. | 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
20.下列家庭小实验能成功的是( )
| A. | 用淬火处理后的缝衣钢针制钓鱼钩 | B. | 用食盐水除去热水瓶中的水垢 | ||
| C. | 用电池“锌皮”与食醋反应制氢气 | D. | 用加热的方法修补电木插座 |
4.对于可逆反应:2A(g)+2B(g)?3C(g)+D(s),减少压强产生的影响的是( )
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
14.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol/L BaCl2溶液中含有的钡离子数为NA | |
| B. | 1 mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 16 g O3中含有的氧原子数为NA |
1.下列有关说法正确的是( )
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
19.下列叙述正确的是( )
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |