题目内容
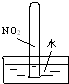
10.下列图示实验正确的是( )| A. | 测量Cu与浓硝酸反应产生气体的体积: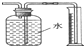 | |
| B. | 验证Na和水反应为放热反应: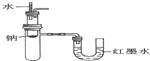 | |
| C. | 制取干燥的氨气: | |
| D. | 收集H2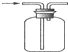 |
分析 A.Cu与浓硝酸反应生成二氧化氮,二氧化氮与水反应;
B.Na和水反应放热,大试管中空气受热膨胀,U型管中红墨水左低右高;
C.氨气能与浓硫酸反应;
D.氢气的密度比空气的密度小.
解答 解:A.Cu与浓硝酸反应生成二氧化氮,二氧化氮与水反应,则不能利用排水法测定其体积,故A错误;
B.由图可知,若U型管中红墨水左低右高,可知Na和水反应放热,大试管中空气受热膨胀,可验证放热反应,故B正确;
C.氨气能与浓硫酸反应,不能选浓硫酸干燥,应选碱石灰,故C错误;
D.氢气的密度比空气的密度小,则应利用向下排空气法,即应从短导管进入,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、气体的制备和收集、反应中的热效应等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列家庭小实验能成功的是( )
| A. | 用淬火处理后的缝衣钢针制钓鱼钩 | B. | 用食盐水除去热水瓶中的水垢 | ||
| C. | 用电池“锌皮”与食醋反应制氢气 | D. | 用加热的方法修补电木插座 |
1.下列有关说法正确的是( )
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
2.下列离子方程式书写正确的是( )
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
19.下列叙述正确的是( )
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
20.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |