题目内容
13.在含有较多NH4+、Ba2+、NO3ˉ、Clˉ的溶液中还能大量共存的离子是( )| A. | Ag+ | B. | H+ | C. | SO42ˉ | D. | OHˉ |
分析 A.银离子与氯离子反应生成氯化银沉淀;
B.氢离子不与题干中四种离子反应;
C.硫酸根离子与钡离子反应生成硫酸钡沉淀;
D.氢氧根离子与铵根离子反应生成弱电解质一水合氨.
解答 解:A.Ag+、Cl-之间反应生成难溶物氯化银,在溶液中不能大量共存,故A错误;
B.H+不反应NH4+、Ba2+、NO3-、Cl-,在溶液中能够大量共存,故B正确;
C.SO42-、Ba2+之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故C错误;
D.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确常见的离子不能共存的情况,如:发生复分解反应、发生氧化还原反应等,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
3.随着社会的发展人们的生活越来越离不开化学.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
4.对于可逆反应:2A(g)+2B(g)?3C(g)+D(s),减少压强产生的影响的是( )
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
1.下列有关说法正确的是( )
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
8.对于反应中的能量变化,下列表述正确的是( )
| A. | 断开化学键的过程会放出能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应中,反应物的总能量大于生成物的总能量 |
2.下列离子方程式书写正确的是( )
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |



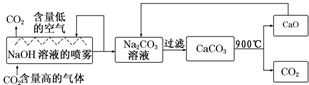
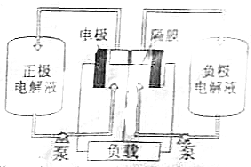 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.