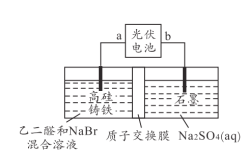
题目内容
【题目】不锈钢(Stainless Steel)是不锈耐酸钢的简称,耐空气、蒸汽、水等腐蚀。不锈钢中含有Fe、Cr等元素。回答下列问题:
(1)铬(Cr)的价电子排布图为______
(2)亚铁氰化钾别名黄血盐,化学式:![]() ,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。
,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。

(3)1mol的![]() 中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
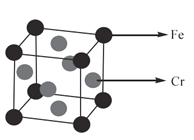
(4)用______实验可以直接确定某固体是否是晶体,某种铁铬合金的晶胞如图所示,该晶体堆积模型为______,空间利用率是______;若已知该晶胞的棱长为a pm,则该晶胞的密度为______g/cm3。
【答案】![]() C< O< N 水和氨气存在分子间氢键,沸点升高 sp杂化 24 碳原子 X-射线衍射 面心立方最密堆积 74%
C< O< N 水和氨气存在分子间氢键,沸点升高 sp杂化 24 碳原子 X-射线衍射 面心立方最密堆积 74% ![]()
【解析】
(1)铬(Cr)为24号元素,价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据元素周期律,同周期从左到右,元素的第一电离能逐渐增大,但因为N元素2p轨道半充满状态,所以N的第一电离能高于O,则C、N、O三元素的第一电离能由小到大顺序为C <O<N;O和N的简单氢化物分别为水、氨气,因为水和氨气都存在分子间氢键,所以沸点明显高于CH4;由图可知,碳原子形成2根σ键,则C原子的杂化方式为sp杂化,故答案为:C <O<N;水和氨气都存在分子间氢键,沸点升高;
(3)![]() 中铁原子与CN-间能形成配位共价键,碳原子与氮原子间能形成叁键,则1mol的
中铁原子与CN-间能形成配位共价键,碳原子与氮原子间能形成叁键,则1mol的![]() 中含有的共价键物质的量为(6+3×6)mol=24mol,由图可知该配位化合物的配位原子为碳原子,故答案为:24;碳原子;
中含有的共价键物质的量为(6+3×6)mol=24mol,由图可知该配位化合物的配位原子为碳原子,故答案为:24;碳原子;
(4)用X-射线衍射实验可以直接确定某固体是否是晶体,由图原子在顶点和面心可知,该晶体堆积模型为面心立方最密堆积,空间利用率是74%;若已知该晶胞的棱长为a pm,由密度计算公式![]() ,即该晶胞的密度为
,即该晶胞的密度为![]() g/cm3,故答案为:X-射线衍射;面心立方最密堆积;74%;
g/cm3,故答案为:X-射线衍射;面心立方最密堆积;74%;![]() 。
。