题目内容
现有V L 0.5mol/L的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )
| A、加热浓缩到原来体积的一半 |
| B、加入0.05mol/L的盐酸0.125V L |
| C、加入10mol/L的盐酸0.1V L,再稀释至1.5 V L |
| D、标况下通入11.2L氯化氢气体 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、加热蒸发HCl挥发,溶液浓度降低;
B、溶液的体积不具有加和性;
C、根据n=cV计算溶质HCl的物质的量,两部分溶液中HCl之和为混合后溶液中的HCl,再根据c=
计算判断;
D、通过氯化氢气体,溶液的体积发生变化.
B、溶液的体积不具有加和性;
C、根据n=cV计算溶质HCl的物质的量,两部分溶液中HCl之和为混合后溶液中的HCl,再根据c=
| n |
| V |
D、通过氯化氢气体,溶液的体积发生变化.
解答:
解:A、加热蒸发HCl挥发,加热浓缩到原来体积的一半,溶液浓度小于原来的2倍,故A错误;
B、溶液的体积不具有加和性,无法求出混合后溶液的体积,故B错误;
C、混合后溶液中的HCl为 0.5mol/L×VL+10mol/L×0.1VL=1.5Vmol,所以混合后HCl的浓度为
=1mol/L,故C正确;
D、通过氯化氢气体,溶液的体积发生变化,无法求出浓度,故D错误;
故选C.
B、溶液的体积不具有加和性,无法求出混合后溶液的体积,故B错误;
C、混合后溶液中的HCl为 0.5mol/L×VL+10mol/L×0.1VL=1.5Vmol,所以混合后HCl的浓度为
| 1.5Vmol |
| 1.5 V L |
D、通过氯化氢气体,溶液的体积发生变化,无法求出浓度,故D错误;
故选C.
点评:本题考查对物质的量浓度的理解与计算,难度不大,注意挥发性溶质在加热蒸发时挥发,浓度降低.

练习册系列答案
相关题目
下列说法正确的是( )
| A、自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| B、硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C、水泥、玻璃、水晶都是硅酸盐制品 |
| D、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,48g O3含有氧原子数为NA |
| B、12g NaHSO4在熔融时离子总数为0.3NA |
| C、氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| D、7.8g Na2O2中含有阴离子数为0.1NA |
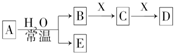 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )| A、若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32-,则E是一种清洁能源 |
| B、若D为CO,C能和E反应,则A一定为Na2O2 |
| C、若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应 |
| D、若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
标况下,在五个烧瓶中分别充入①纯净的氨气②混有
空气的HCl③纯净的NO2④NO2与O2体积比4:1⑤NO与O2体积比4:3.然后做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
| 1 |
| 5 |
| A、①=②=③=④=⑤ |
| B、①=②=③>④>⑤ |
| C、①=②=③>⑤>④ |
| D、①>③>②>⑤>④ |
用排空气法收集的氨气烧瓶做喷泉实验后,当水上升到整个烧瓶体积的
,则烧瓶内的氨水的物质量浓度是(按标准状况下计算)( )
| 2 |
| 3 |
| A、0.045mol/L |
| B、0.03mol/L |
| C、1mol/L |
| D、不能确定 |
要从AlCl3溶液中制得Al(OH)3,最好的方法是( )
| A、加入NaOH溶液 |
| B、加入Ba(OH)2溶液 |
| C、加入氨水 |
| D、加入石灰水 |
已知:家用消毒液的主要成分是NaClO和NaCl,通常由氯气与氢氧化钠反应来制取.请判断下列反应需加入适当氧化剂才能实现的是( )
| A、Cl2→NaClO |
| B、MnO2→Mn2+ |
| C、SO2→SO32- |
| D、PCl3→PCl5 |