题目内容
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.碳酸根离子水解程度远远大于碳酸氢根离子水解程度,碳酸根离子和碳酸氢根离子水解导致溶液呈碱性;
C.任何电解质溶液中都遵循质子守恒,根据质子守恒判断;
D.任何电解质溶液中都遵循质子守恒,根据质子守恒判断.
B.碳酸根离子水解程度远远大于碳酸氢根离子水解程度,碳酸根离子和碳酸氢根离子水解导致溶液呈碱性;
C.任何电解质溶液中都遵循质子守恒,根据质子守恒判断;
D.任何电解质溶液中都遵循质子守恒,根据质子守恒判断.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),故A正确;
B.碳酸根离子水解程度远远大于碳酸氢根离子水解程度,碳酸根离子和碳酸氢根离子水解导致溶液呈碱性,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故B正确;
C.任何电解质溶液中都遵循质子守恒,根据质子守恒得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.任何电解质溶液中都遵循质子守恒,根据质子守恒得c(OH-)=c(CH3COOH)+c(H+),根据D正确;
故选C.
B.碳酸根离子水解程度远远大于碳酸氢根离子水解程度,碳酸根离子和碳酸氢根离子水解导致溶液呈碱性,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故B正确;
C.任何电解质溶液中都遵循质子守恒,根据质子守恒得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.任何电解质溶液中都遵循质子守恒,根据质子守恒得c(OH-)=c(CH3COOH)+c(H+),根据D正确;
故选C.
点评:本题考查了离子浓度大小比较,根据溶液中的电解质特点结合守恒思想分析解答,注意碳酸氢钠和碳酸钠溶液中质子守恒等式的不同点,为易错点.

练习册系列答案
相关题目
下列对应的表达方式错误的是( )
A、Cl-的结构示意图: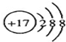 | ||
B、氢氧根离子的电子式: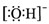 | ||
C、碳-12原子:
| ||
| D、HClO的结构式:H-Cl-O |
下列贮存化学试剂的方法错误的是( )
| A、新制的氯水保存在棕色细口瓶中,并放在阴凉处 |
| B、金属钠保存在煤油中 |
| C、FeSO4溶液存放在加少量铁粉的试剂瓶中 |
| D、烧碱溶液置于带玻璃塞的磨口试剂瓶 |
据报道,火星和金星大气层中可能存在一种非常特殊的气态化合物.这种化合物会导致温室效应,它的结构式为16O=C=18O.则16O=C=18O( )
| A、与16O=C=16O互为同素异形体 |
| B、与18O=C=18O有几乎相同的化学性质 |
| C、与Na216O2反应生成的氧气中含有18O |
| D、与等质量的16O=C=16O和18O=C=18O混合气体含有相同的原子个数 |
现有浓度均为0.10mol?L-1的醋酸V1 mL和氢氧化钠溶液V2 mL,下列说法正确的是( )
| A、常温下,上述溶液中,醋酸溶液的pH=1,氢氧化钠溶液的pH=13 |
| B、常温下,若两溶液混合后pH=7,则混合液:c(Na+)=c(CH3COO-) |
| C、若 V1=V2,将两溶液混合,所得混合液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、V1与V2任意比混合,所得混合液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
下列操作方法错误的是( )
| A、检验HCl气体中是否混有Cl2,可用用湿润的淀粉碘化钾试纸 |
| B、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,能证明该溶液中一定含有SO42- |
| C、向某溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色,能证明该溶液中含有Fe2+ |
| D、NH3可以用NH4Cl固体和氢氧化钙混合加热制取,用碱石灰干燥 |
现有V L 0.5mol/L的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )
| A、加热浓缩到原来体积的一半 |
| B、加入0.05mol/L的盐酸0.125V L |
| C、加入10mol/L的盐酸0.1V L,再稀释至1.5 V L |
| D、标况下通入11.2L氯化氢气体 |
某二种气态混合烃1L,完全燃烧后生成1.4L CO2和1.6L水蒸气(体积均在相同条件下测得),该混合烃是( )
| A、乙烷、乙炔 |
| B、甲烷、乙炔 |
| C、甲烷、丙炔 |
| D、乙烷、丙炔 |