题目内容
2.工业上制取硝酸铵的流程图如图1,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是氧化炉,其中发生反应的化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)此生产过程中,N2与H2合成NH3所用的催化剂是铁砂网.
1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程.示意图如图2:
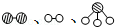 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.(3)在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源;在合成硝酸的吸收塔中通入空气的目的是使NO循环利用,全部转化为硝酸.
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O氨气还原法:8NH3+6NO2 $?_{△}^{催化剂}$7N2+12H2O(NO也有类似的反应)以上两种方法中,符合绿色化学的是氨气还原法.
(5)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的53%.
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表.
| 注意事项 | 理由 |
| ①不能与碱性肥料混施 | |
| ②不能剧烈撞击 |
分析 (1)氨气在氧化炉中被催化氧化;氨气被氧化为NO和水;
(2)N2与H2合成NH3所用的催化剂是铁砂网;图②中两种双原子分子被吸附在催化剂表面;③中分子中的化学键断裂生成原子;
(3)合成氨的反应属于放热反应,热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,NO能被氧气氧化为二氧化氮;
(4)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(5)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(6)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
解答 解:(1)氨气在氧化炉中被催化氧化,B设备的名称是;氨气被氧化为NO和水,其反应的方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:氧化炉;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)N2与H2合成NH3所用的催化剂是铁砂网;图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子;
故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂;
(3)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:利用余热,节约能源;使NO循环利用,全部转化为硝酸;
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2 $\frac{\underline{催化剂}}{△}$7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,
故答案为:氨气还原法;
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为$\frac{1mol}{1mol+0.8832mol}$×100%=53%;即制HNO3所用去的NH3的质量占总耗NH3质量的53%,
故答案为:53;
(6)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH4NO3$\frac{\underline{\;撞击\;}}{\;}$N2O↑+2H2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失,所以:
| 注意事项 | 理由 |
| ①不能与碱性肥料混施 | 硝酸铵溶液呈碱性 |
| ②不能剧烈撞击 | 硝酸铵易爆炸 |
| 注意事项 | 理由 |
| ①不能与碱性肥料混施 | 硝酸铵溶液呈碱性 |
| ②不能剧烈撞击 | 硝酸铵易爆炸 |
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 制取气体:先检验装置的气密性,后加入药品 | |
| B. | 点燃可燃性气体:先检验气体的纯度,后点燃 | |
| C. | CO还原氧化铁实验结束时:先停止通CO,后撤离酒精灯停止加热 | |
| D. | 除去H2中混有的CO2和H2O蒸汽,先通过氢氧化钠溶液,后通过浓硫酸 |
| A. | 5mol | B. | 10mol | C. | 20mol | D. | 30mol |
| A. | 12753I和12953I2互为同位素 | |
| B. | NH5的电子式为  | |
| C. | 氯原子的结构示意图: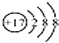 | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
| A. | HCl+Na2CO3═HCl+NaHCO3 | B. | HCl+Na2CO3═H2SO4+K2CO3 | ||
| C. | H2S+NaOH═H2SO4+KOH | D. | BaCl2+Na2SO4═BaCO3+H2SO4 |
| A. | 23 | B. | 46 | C. | 69 | D. | 92 |
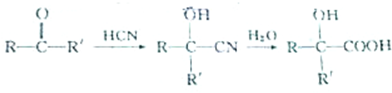 产物分子比原化合物分子多出一个碳原子,增长了碳链.
产物分子比原化合物分子多出一个碳原子,增长了碳链.
 .
.