题目内容
12.化学实验操作中常涉及“先后”问题,下列操作的先后顺序错误的是( )| A. | 制取气体:先检验装置的气密性,后加入药品 | |
| B. | 点燃可燃性气体:先检验气体的纯度,后点燃 | |
| C. | CO还原氧化铁实验结束时:先停止通CO,后撤离酒精灯停止加热 | |
| D. | 除去H2中混有的CO2和H2O蒸汽,先通过氢氧化钠溶液,后通过浓硫酸 |
分析 A.制取气体的步骤:“查、装、定、点、收、移、熄”,各步骤不能颠倒;
B.可燃性气体在使用前,必须检验纯度;
C.CO与氧化铁反应制取铁的实验结束时,应该先停灯,再停一氧化碳得输入;
D.后通过浓硫酸,防止进入氢氧化钠溶液时再次带出水分.
解答 解:A.制取气体时,先检查装置的气密性,后装药品,故A正确;
B.试验气体的可燃性时,先检验气体的纯度,后点燃,故B正确;
C.先停止通入CO,后停止加热固体,热的铁会与空气中的氧气发生氧化反应,重新生成氧化铁,故C错误.
D.除去H2中混有的CO2和H2O蒸汽,先通过氢氧化钠溶液,后通过浓硫酸,防止进入氢氧化钠溶液时再次带出水分,故D正确.
故选C.
点评 本题考查化学实验操作的先后顺序,难度不大,主要探究实验的步骤,以及实验操作中的注意事项,掌握制取常用气体的方法原理和注意事项.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
2.食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂.下列物质不属于食品抗氧化剂的是( )
| A. | 糕点中的配料维生素C | B. | 方便面里的味精(谷氨酸钠) | ||
| C. | 葡萄酒中的少量二氧化硫 | D. | 火腿肠中的少量亚硝酸钠 |
3.一定温度时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:PCl5(g)?Cl2(g)+PCl3(g)经一段时间后反应达到平衡.反应过程中测得的部分数据见下表:
下列说法正确的是( )
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s内的平均速率为v(PCl3)=0.0032 moI•L-l•s-l | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI•L-l,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)<v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0mol PCl3、1.0 mol Cl2,则反应达到平衡时PCl3的转化率为80% |
20.下列说法正确的是( )
| A. | 加入苯酚显紫色的溶液不可能大量共存:Na+、HCO3-、Fe2+、I- | |
| B. | 含有大量NO3-的溶液可以大量共存:H+、Fe2+、Cl-、SO42- | |
| C. | 将足量CO2通入下列溶液后仍然能大量共存:Na+、C6H5O-、CH3COO-、AlO2- | |
| D. | 在溶液中加入足量Na2O2后仍能大量共存:Na+、Cl-、CO32-、SO42-、Fe2+ |
17.下列叙述中正确的是( )
| A. | Ba(OH)2的电离方程式为:Ba(OH)2?Ba2++(OH)22- | |
| B. | 易溶于水的物质一定是电解质,难溶于水的物质一定不是电解质 | |
| C. | 硫酸铝熔化时发生了电离,可表示为:Al2(SO4)═2Al3++3SO42- | |
| D. | 虽然CO2水溶液的导电能力较弱,但CO2仍是电解质 |
4.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O=Al(OH)3(胶体)+3H+.
| 阳离子 | k+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O=Al(OH)3(胶体)+3H+.
1.在2L密闭容器中,把2mol X和2mol Y混合,发生如下反应:3X(g)+Y(g)═nP(g)+2Q(g),当反应经2min达到平衡,测得P的浓度为0.8mol/L,Q的浓度为0.4mol/L,则下列判断中,不正确的是( )
| A. | n=4 | |
| B. | X的转化率为60% | |
| C. | X的平衡浓度为0.4mol/L | |
| D. | 2 min内Y的平均速率为0.4mol/(L.min) |

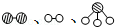 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.