题目内容
14.在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则该混合物中的CaCl2的质量分数为42.7%.分析 K+与Ca2+的物质的量之比为2:1,设二者物质的量分别为2mol、1mol,则KCl为2mol、CaCl2为1mol,根据m=nM计算二者质量,进而计算CaCl2的质量分数.
解答 解:K+与Ca2+的物质的量之比为2:1,设二者物质的量分别为2mol、1mol,则KCl为2mol、CaCl2为1mol,故CaCl2的质量分数=$\frac{1mol×111g/mol}{2mol×74.5g/mol+1mol×111g/mol}$×100%=42.7%,
故答案为:42.7%.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
4.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O=Al(OH)3(胶体)+3H+.
| 阳离子 | k+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3、D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O=Al(OH)3(胶体)+3H+.
9.下图是吸热反应的是( )
| A. | 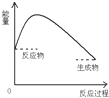 | B. | 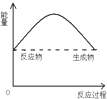 | C. |  | D. | 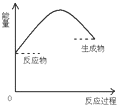 |


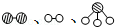 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.