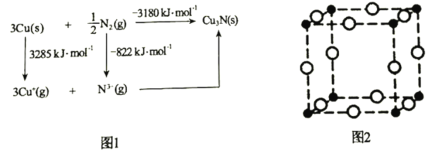
题目内容
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )

A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
【答案】B
【解析】
A.放热反应Zn+H2SO4═ZnSO4+H2↑,则放热反应中反应物的总能量大于生成物的总能量,故A正确;
B.加入少许CuSO4溶液,Zn置换出Cu,形成ZnCu硫酸原电池,使Zn与稀硫酸的反应速率加快,故B错误;
C.Zn+H2SO4═ZnSO4+H2↑的反应中锌失去电子,化合价升高,作原电池的负极,故C正确;
D.在Zn+H2SO4=ZnSO4+H2↑反应中每转移2mol电子参加反应的Zn为1mol,现转移4mol电子,参加反应的Zn为2mol,则反应释放出2QkJ热量,故D正确;
答案选B。

练习册系列答案
相关题目
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D