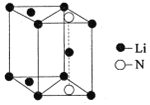
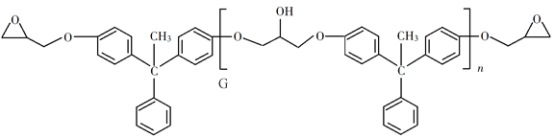
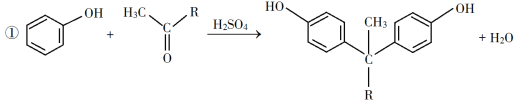
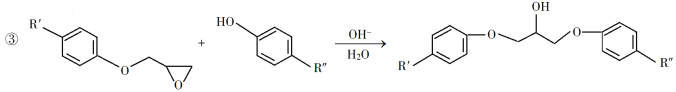
题目内容
【题目】某温度时,在2 L的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
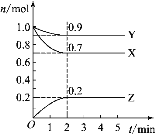
(1)由图中数据分析,该反应的化学方程式_____________。
(2)从反应开始至2 min,Z的平均反应速率为________。
(3)第5 min时,Z的生成速率________(填“大于”“小于”或“等于”)Z的消耗速率。
(4)第_______分钟时,反应达到平衡。
【答案】![]() 0.05mol(Lmin)-1 等于 2
0.05mol(Lmin)-1 等于 2
【解析】
(1)由图中数据分析,X、Y的物质的量减小,是反应物,Z的物质的量增加,为生成物,在2min内X、Y、Z分别改变了0.3mol、0.1mol、0.2mol,根据反应改变量之比等于化学计量系数比,且2min以后各物质的量均不再变化,说明该反应为可逆反应,综上所述:该反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)从反应开始至2 min,Z的平均反应速率为![]() ,故答案为:0.05mol(Lmin)-1;
,故答案为:0.05mol(Lmin)-1;
(3)第5 min时,Z的物质的量保持不变说明反应已经达到化学平衡,故Z的生成速率等于Z的消耗速率,故答案为:等于
(4)从图中可以看出,从2min末开始各组分的物质的量就不再发生变化了,故第2分钟时,反应达到平衡,故答案为:2。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】下列实验操作中,根据实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
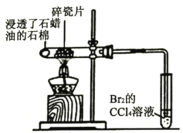
A |
| Br2的CCl4溶液褪色 | 石蜡油分解产生乙烯气体 |
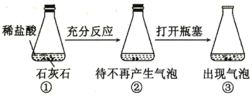
B |
| ③中出现气泡 | 可以用平衡移动原理解释 |
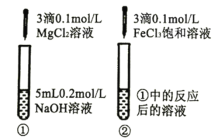
C |
| ①中出现白色沉淀 ②中出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
D |
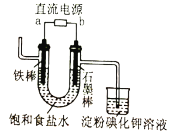
| 淀粉碘化钾溶液变蓝 | b为直流电源负极 |
A.AB.BC.CD.D
【题目】重铬酸钾(K2Cr2O7)常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:I.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II.相关金属离子形成氢氧化物沉淀的pH范围:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
回答下列问题:
(1)滤渣②的成分是________________。
(2)写出“氧化”步骤中反应的化学方程式________________。
(3)“加热”操作的目的是________________。
(4)根据平衡移动原理解释酸化至pH=1的目的是________________(用离子方程式和适当文字说明)。
(5)通过下列实验可测定产品中K2Cr2O7(M=294g/mol)的纯度:称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/LNa2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。则所测定产品中K2Cr2O7的纯度为________________。
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。

①负极的电极反应式为________________;
②一段时间后,中间室NaCl溶液的浓度________________(填“增大”“减小”或“不变”)。