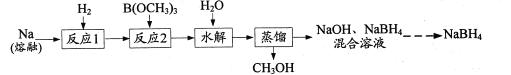
题目内容
【题目】氮(N)、硝(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态砷原子的价电子排布图为________________,第三周期元素的原子中,第一电离能大于磷原子的有________________种。
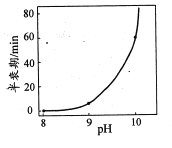
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________________(填序号)。
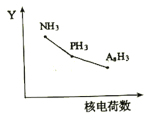
A.稳定性B.沸点时C.R-H键之间的键角D.分子间作用力E.还原性
(3)经测定发现,某种N2O5固体由NO2+和NO3-两种离子组成,阳离子中N原子的杂化方式是________________杂化,阴离子的空间构型为________________。
(4)乙二胺(H2N-CH2-CH2-NH2)与CuCl2溶液可形成配离子(结构如图)。
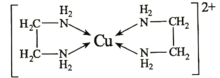
Cu2+的配位数为________________,1mol该配离子中含σ键为________________mol,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是________________。
(5)通常认为Cu3N是离子晶体,其晶格能可通过图1的Born-Haber循环计算得到。通过图1中数据________________(填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为________________kJ·mol-1。
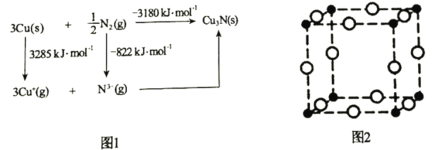
(6)Cu3N晶胞如图2所示,Cu+的半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为________________g·cm-3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
【答案】 2 AC sp 平面正三角形 4 26 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 不能 5643
2 AC sp 平面正三角形 4 26 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 不能 5643 ![]()
【解析】
(1)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,其价层电子排布式为:4s24p3,则基态砷原子的价电子排布图为 ;同周期元素第一电离能从左至右有逐渐增大的趋势,磷原子的基态电子排布式为:1s22s22p63s23p3,最外层电子3p轨道电子处于半满较稳定状态,第一电离能比同周期相邻的Si和S元素的大,第三周期元素的原子中,第一电离能最大的为零族元素Ar,则第一电离能大于磷原子的有Cl和Ar两种元素;
;同周期元素第一电离能从左至右有逐渐增大的趋势,磷原子的基态电子排布式为:1s22s22p63s23p3,最外层电子3p轨道电子处于半满较稳定状态,第一电离能比同周期相邻的Si和S元素的大,第三周期元素的原子中,第一电离能最大的为零族元素Ar,则第一电离能大于磷原子的有Cl和Ar两种元素;
(2)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,与图像不符,故B错误;
C.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,元素的电负性越强,电负性大的使电子对之间的斥力变大,键角越大,N、P、As电负性逐渐减小,R-H键之间的键角也逐渐减小,与图像相符,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,与图像不符,故D错误;
E.氢化物的还原性,主要比较阴离子的还原性,N、P、As位于周期表同一主族,从上到下非金属性减弱,元素的非金属性越强,其单质的氧化性越强,对应阴离子的还原性越弱,则氢化物的还原性越弱,与图像不符,故E错误;
答案选AC;
(3)NO2+中N原子价层电子对个数=2+![]() =2、NO3-中N原子价层电子对个数=3+
=2、NO3-中N原子价层电子对个数=3+![]() =3,根据价层电子对互斥理论判断,阳离子中N原子的杂化方式是sp,阴离子中N原子的杂化方式是sp2,空间构型为平面正三角形;
=3,根据价层电子对互斥理论判断,阳离子中N原子的杂化方式是sp,阴离子中N原子的杂化方式是sp2,空间构型为平面正三角形;
(4)根据图示,Cu2+与4个N原子形成配位键,则Cu2+的配位数为4;配位键和单键都是σ键,该配离子中含有4个配位键和22个单键,则1mol该该配离子含σ键为26mol;乙二胺分子之间形成氢键,三甲胺分子之间不能形成氢键,乙二胺比三甲胺的沸点高的多;
(5)Cu原子的第一电离能为Cu(g)原子失去1个电子形成Cu+(g)所需要的能量,图示中只给出了固态铜原子失去电子的能量,铜原子由固态变为气态也有能量变化,图示中没有给出,故不能计算出Cu原子的第一电离能;Cu3N晶格能是Cu+、N3气态离子形成1molCu3N晶体释放的能量,设Cu3N的晶格能为akJmol1,根据盖斯定律,则:3285kJ/mol822kJ/molakJ/mol=3180kJ/mol,解得a=5643;
(6)由晶胞结构,白色球位于晶胞棱心,个数为![]() ×12=3,黑色球位于晶胞的顶点,个数为
×12=3,黑色球位于晶胞的顶点,个数为![]() ×8=1,白色球与黑色球个数比为3:1,可知顶点黑色球是N3,棱中心白色球是Cu+,结合图示,晶胞的边长为黑色球与白色球直径之和,已知:Cu+的半径为apm,N3-的半径为bpm,则晶胞的边长=2×(a+b)pm=2×(a+b)×10-10 cm,则立方体晶胞的体积V=8×(a+b)3×10-30 cm3,故Cu3N晶胞的密度=
×8=1,白色球与黑色球个数比为3:1,可知顶点黑色球是N3,棱中心白色球是Cu+,结合图示,晶胞的边长为黑色球与白色球直径之和,已知:Cu+的半径为apm,N3-的半径为bpm,则晶胞的边长=2×(a+b)pm=2×(a+b)×10-10 cm,则立方体晶胞的体积V=8×(a+b)3×10-30 cm3,故Cu3N晶胞的密度= =
=![]() g·cm-3。
g·cm-3。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D