题目内容
【题目】为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。请写出②中反应的化学方程式______。
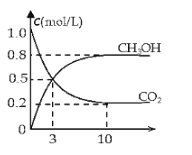
(2)如将CO2与H2以1:3的体积比混合,在适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施有______。(只写一种即可)
【答案】2KHCO3![]() K2CO3+H2O+CO2↑ 0.24mol/(L
K2CO3+H2O+CO2↑ 0.24mol/(L![]() min) 80% 降低温度(或加压或增大H2的量等)
min) 80% 降低温度(或加压或增大H2的量等)
【解析】
(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸氢钾分解生成碳酸钾、二氧化碳与水;
(2)由图可知,10min达平衡,平衡时甲醇的浓度变化为0.8mol/L,根据![]() 计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
根据CH3OH平衡浓度,利用n=cV计算△n(CH3OH),再根据方程式计算△n(H2),利用转化率等于计算氢气的转化率;
改变体积使平衡向正反应移动,可以增大CH3OH的物质的量,据此结合方程式特征解答。
(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸氢钾分解生成碳酸钾、二氧化碳与水,反应方程式为:2KHCO3![]() K2CO3+H2O+CO2↑;
K2CO3+H2O+CO2↑;
故答案为:2KHCO3![]() K2CO3+H2O+CO2↑;
K2CO3+H2O+CO2↑;
(2)由图可知,10min达平衡,平衡时甲醇的浓度变化为0.8mol/L,则10分钟内,v(CH3OH)=0.08mol/(L![]() min),根据速率之比等于化学计量数之比,故v(H2)=3 v(CH3OH)=3×0.08mol/(Lmin)=0.24mol/(L
min),根据速率之比等于化学计量数之比,故v(H2)=3 v(CH3OH)=3×0.08mol/(Lmin)=0.24mol/(L![]() min),平衡时△n(CH3OH)=0.8mol/L×2L=1.6mol,根据方程式可知△n (H2)=3△n(CH3OH)=3×1.6mol=4.8mol,所以氢气的转化率为
min),平衡时△n(CH3OH)=0.8mol/L×2L=1.6mol,根据方程式可知△n (H2)=3△n(CH3OH)=3×1.6mol=4.8mol,所以氢气的转化率为![]() ×100%=80%;
×100%=80%;
该反应正反应是体积减小的放热反应,故降低温度或加压或增大H2的量等,可以是平衡向正反应移动,增大CH3OH的物质的量;
故答案为:0.24mol/(L![]() min);80%;降低温度(或加压或增大H2的量等)。
min);80%;降低温度(或加压或增大H2的量等)。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2。
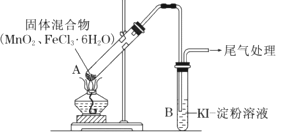
资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
ⅰ.实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是______。
可能原因②:______;
反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。
【题目】FTO导电玻璃为抄杂氟的SnO2透明导电玻璃,r泛用于液晶显示屏,薄膜太阳能电池基底等方面,SnCl4可用于制作FTO导电玻璃。实验室可用熔融的锡与Cl2反应制备SnCl4,此反应放热,生成的SnCl4易水解生成SnO2XH2O。回答下列问题:

有关物理性质如下表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 231.9 | 2260 |
SnCl4 | 无色液体 | -33 | 114 |
SnCl2 | 无色晶体 | 246 | 652 |
(1)将上述装置用玻璃管连接,组装成一套制备SnCl4的实验装置(每个装置最多使用一次),正确的顺序是:(填各接口的字母)
B →____ →____ →____ →____→_____N→A→____ →___→____→____;
(2)Ⅲ处中应选用的冷凝管为_______(填选项字母);

(3)检查装置气密性并装好药晶后,应先______待出现______再点燃I处的酒精灯,否则会有副反应发生:①___________________.②_________________(用化学方程式表示);
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为减少产晶中SnCl2的量,可采取的措施是_______________________________、____________________________________;
(5)已知Fe3++Sn2+—Fe2++Sn4+(未配平)。准确称取样品mg于饶杯中。用少量浓盐酸溶解。加入过量的氧化铁溶液,再加水稀释,配制成250 mL.溶液。取25.00 mL于锥形瓶中。用0.1000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗标准液15.00 mL.则产品中SnCl2的含量W _______% (用含m的代数式表示)。