题目内容
【题目】汽车尾气及硝酸工业废气中氮氧化物的处理是治理环境污染的重要课题。
(1)汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应I:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H1
N2(g)+2CO2(g)△H1
反应II:N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol-1
2NO(g)△H2=+180.5kJ·mol-1
已知CO的燃烧热为283.0kJ·mol-1,则△H1=________________。
(2)某研究小组探究催化剂对上述反应I的影响。将NO和CO混合气体以定的流速分别通过两种不同的催化剂a和b进行反应,在相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),得到图1中a、b两条曲线。温度低于200℃时,图1中曲线a脱氮率随温度升高而变化不大的主要原因为________________;m点________________(填“是”或者“不是”)对应温度下的平衡脱氮率,说明理由________________。

(3)一定条件下Cl2也可以与NO反应,生成一种有机合成中的重要试剂亚硝酰氯(NOCl),化学方程式为:2NO(g)+Cl2(g)![]() 2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[
2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[![]() ]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
①图2中T1、T2的关系为T1________________T2(填“>”“<”或“=”)。
②图2中纵坐标为反应物________________的转化率,理由为________________。
③若在温度为T1,容积为1L恒容密闭的容器中反应,经过10min到达A点,则0~10min内反应速率v(NO)=________________mol·L-1·min-1。
④已知:用气体分压替代浓度计算的平衡常数叫压强平衡常数(Kp);分压=总压×气体物质的量分数。若该反应的起始压强为P0kPa,T1温度下该反应的压强平衡常数(Kp)为________________(用含P0的代数式表示)。
【答案】﹣746.5kJ·mol1 温度较低时,催化剂的活性偏低 不是 因为该反应为放热反应,根据曲线b可知,m点对应温度的平衡脱氮率应该更高(或其他合理解释) < Cl2(或氯气) 随着氮氯比[![]() ]增加时氯气的转化率逐渐增大 0.12
]增加时氯气的转化率逐渐增大 0.12 ![]() kPa-1 (或
kPa-1 (或![]() kPa-1)
kPa-1)
【解析】
(1)已知:CO燃烧热的△H1=283.0kJmoll,热化学方程式为:①CO(g)+![]() O2(g)=CO2(g)△H1=283.0 kJ·moll,②N2(g)+O2(g)2NO(g)△H2=+180.5 kJ·mol1,根据盖斯定律计算①×2②得到:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=746.5kJ/mol;
O2(g)=CO2(g)△H1=283.0 kJ·moll,②N2(g)+O2(g)2NO(g)△H2=+180.5 kJ·mol1,根据盖斯定律计算①×2②得到:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=746.5kJ/mol;
(2)由于催化剂在低温下活性不大,因此反应随温度变化速率变化不大;由于该反应为放热反应,根据线b可知,m点对温度的平衡脱氮率应该更高,所以图象分析可知m点不是对应温度下的平衡脱氮率:
(3)①2NO(g)+Cl2(g)2NOCl(g)△H<0,反应为放热反应,升温平衡逆向进行,一定氮氯比条件下,升温平衡逆向进行,反应物平衡转化率减小,则T1<T2;
②保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示,![]() 越大,转化率越大,说明纵轴表示的是Cl2 (氯气)的转化率;
越大,转化率越大,说明纵轴表示的是Cl2 (氯气)的转化率;
③在温度为T1,2NO(g)+Cl2(g)2NOCl(g)△H<0,保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比进行反应,A点氯气转化率为0.6,![]() =2,体积为1L,结合三行计算列式计算,
=2,体积为1L,结合三行计算列式计算,

则v(NO)=![]() =
=![]() =0.12mol/(Lmin);
=0.12mol/(Lmin);
④结合③题的列式,相同条件下,压强之比等于物质的量之比,则![]() ,p平=0.8p0kPa,故T1温度下该反应的压强平衡常数Kp =
,p平=0.8p0kPa,故T1温度下该反应的压强平衡常数Kp = =
=![]() kPa-1 (或
kPa-1 (或![]() kPa-1)。
kPa-1)。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】下列实验操作中,根据实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
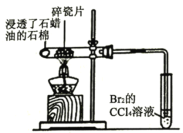
A |
| Br2的CCl4溶液褪色 | 石蜡油分解产生乙烯气体 |
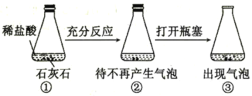
B |
| ③中出现气泡 | 可以用平衡移动原理解释 |
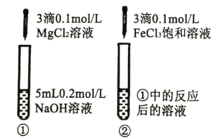
C |
| ①中出现白色沉淀 ②中出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
D |
| 淀粉碘化钾溶液变蓝 | b为直流电源负极 |
A.AB.BC.CD.D
【题目】重铬酸钾(K2Cr2O7)常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:I.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II.相关金属离子形成氢氧化物沉淀的pH范围:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
回答下列问题:
(1)滤渣②的成分是________________。
(2)写出“氧化”步骤中反应的化学方程式________________。
(3)“加热”操作的目的是________________。
(4)根据平衡移动原理解释酸化至pH=1的目的是________________(用离子方程式和适当文字说明)。
(5)通过下列实验可测定产品中K2Cr2O7(M=294g/mol)的纯度:称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/LNa2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。则所测定产品中K2Cr2O7的纯度为________________。
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
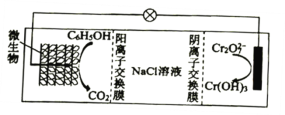
①负极的电极反应式为________________;
②一段时间后,中间室NaCl溶液的浓度________________(填“增大”“减小”或“不变”)。
【题目】FTO导电玻璃为抄杂氟的SnO2透明导电玻璃,r泛用于液晶显示屏,薄膜太阳能电池基底等方面,SnCl4可用于制作FTO导电玻璃。实验室可用熔融的锡与Cl2反应制备SnCl4,此反应放热,生成的SnCl4易水解生成SnO2XH2O。回答下列问题:
有关物理性质如下表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 231.9 | 2260 |
SnCl4 | 无色液体 | -33 | 114 |
SnCl2 | 无色晶体 | 246 | 652 |
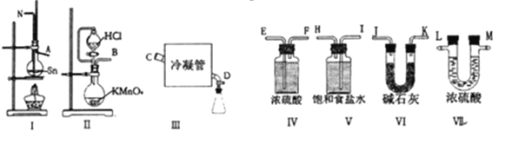
(1)将上述装置用玻璃管连接,组装成一套制备SnCl4的实验装置(每个装置最多使用一次),正确的顺序是:(填各接口的字母)
B →____ →____ →____ →____→_____N→A→____ →___→____→____;
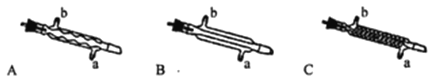
(2)Ⅲ处中应选用的冷凝管为_______(填选项字母);
(3)检查装置气密性并装好药晶后,应先______待出现______再点燃I处的酒精灯,否则会有副反应发生:①___________________.②_________________(用化学方程式表示);
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为减少产晶中SnCl2的量,可采取的措施是_______________________________、____________________________________;
(5)已知Fe3++Sn2+—Fe2++Sn4+(未配平)。准确称取样品mg于饶杯中。用少量浓盐酸溶解。加入过量的氧化铁溶液,再加水稀释,配制成250 mL.溶液。取25.00 mL于锥形瓶中。用0.1000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗标准液15.00 mL.则产品中SnCl2的含量W _______% (用含m的代数式表示)。