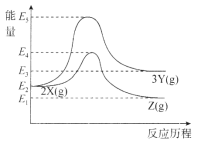
题目内容
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
【答案】NH4+ 热水溶解,趁热过滤 将Ag2S中S2-氧化 ![]()
![]() 将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
【解析】
由实验流程可知,含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸反应生成AgCl(含有少量PbCl2、Ag2S)和滤液,然后除去杂质PbCl2、Ag2S,将AgCl溶于浓氨水中,再利用过量的Zn置换Ag,将水洗后所得粗银溶于过量得稀硫酸中,过滤,滤渣加入过量稀硝酸充分反应,将所得AgNO3溶液,加热浓缩、冷却结晶,得到硝酸银晶体,以此分析。
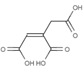
(1)含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸发生反应:![]() ,
,![]() ,则滤液中主要阳离子为NH4+,
,则滤液中主要阳离子为NH4+,
故答案为:NH4+;
(2)根据溶解度曲线可知PbCl2的溶解度随着温度的升高而增大,则除去PbCl2的操作为热水溶解,趁热过滤,热水洗涤;利用浓硝酸可以氧化S2-使沉淀平衡正移,再加入稀盐酸,生成AgCl沉淀,则除去Ag2S的操作为向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl,
故答案为:热水溶解,趁热过滤;将Ag2S中S2-氧化;
(3)![]() 的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数
的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数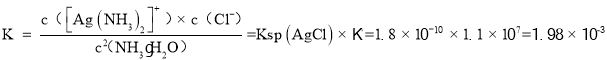 ,
,
故答案为:![]() ;
;
(4)Zn与银氨溶液反应方程式为:![]() ,
,
故答案为:![]() ;
;
(5)粗银中含有少量的Zn,以水洗后粗银为原料,制备硝酸银晶体的实验方案为:将水洗后所得粗银溶于过量得稀硫酸中,过滤,洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液热浓缩、冷却结晶,将所得晶体置于烘箱 (120℃)干燥,密封包装。
故答案为:将水洗后所得粗银溶于过量得稀硫酸中;洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应;加热浓缩、冷却结晶。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案