题目内容
【题目】二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
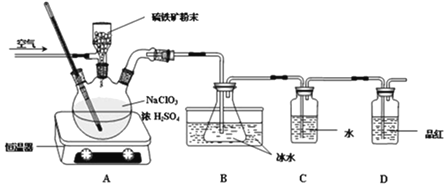
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:__ClO3- +__FeS2+__H+=____ClO2+____Fe3++____SO42-+____H2O
(2)装置D的作用是__________。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①操作Ⅰ的名称为:___________。
②试剂X是___________,写出发生的主要反应的离子方程式__________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为___________。(保留4位有效数字)
【答案】15 1 14 15 1 2 7 检验ClO2是否吸收完全 过滤 Fe 2Fe3++Fe=3Fe2+ 11.76%
【解析】
A装置是制取ClO2;ClO2易溶于水,沸点11℃,遇热不稳定易分解发生爆炸,B装置是冷凝收集ClO2,C装置吸收未冷凝的气态ClO2;ClO2有强氧化性,能使品红褪色,D装置品红能被ClO2氧化而导致品红褪色,是检验ClO2是否被完全吸收干净,根据氧化还原反应的原理分析解答(1)和(2);
(3)上述反应完后的废液中主要含有Fe3+,还有Al3+、Mg2+、H+、Cl-等,根据流程图,在废液中加入过量的X后可得硫酸亚铁,则X为铁;在硫酸亚铁晶体加入硫酸铵溶液,再蒸发浓缩、冷却结晶,再减压过滤可得(NH4)2Fe(SO4)26H2O晶体,根据得失电子守恒可得关系式5Fe2+~MnO4-,根据KMnO4的物质的量可计算出样品中铁元素的质量,进而计算铁元素的质量分数,据此分析解答。
(1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式为15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,故答案为:15;1;14;15;1;2;7;
(2)ClO2有强氧化性,能使品红褪色,所以装置D的作用是检验ClO2是否吸收完全,故答案为:检验ClO2是否吸收完全;
(3)上述反应完后的废液中主要含有Fe3+,还有Al3+、Mg2+、H+、Cl-等,根据流程图,在废液中加入过量的X后可得硫酸亚铁,则X为铁;在硫酸亚铁晶体加入硫酸铵溶液,再蒸发浓缩、冷却结晶,再减压过滤可得(NH4)2Fe(SO4)26H2O晶体。
①根据上面的分析可知,操作Ⅰ是分离固体和溶液,为过滤,故答案为:过滤;
②根据上面的分析可知,试剂X是 Fe,发生的主要反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:Fe;2Fe3++Fe=3Fe2+;
③根据电子得失守恒可得关系式5Fe2+~MnO4-,反应中消耗的KMnO4的物质的量为0.01000mol/L×21.00×10-3L=2.1×10-4mol,所以样品中铁元素的质量为2.1×10-4mol×5×![]() ×56g/mol=0.588g,故铁元素的质量分数为
×56g/mol=0.588g,故铁元素的质量分数为![]() ×100%=11.76%,故答案为:11.76%。
×100%=11.76%,故答案为:11.76%。

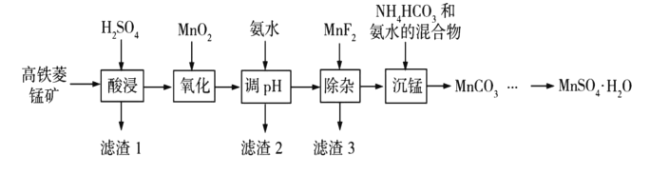
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 等杂质)制备,部分工艺流程如下:
等杂质)制备,部分工艺流程如下:
相关金属离子生成氢氧化物沉淀的![]() 如表(开始沉淀的
如表(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为___________;
(2)“调pH”范围至5~6,得到滤渣2的主要成分除![]() 外还有___________;
外还有___________;
(3)“除杂”过程中加入![]() 的目的是___________;
的目的是___________;
(4)“沉锰”过程中发生反应的化学方程式为___________;
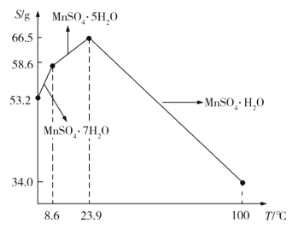
(5)![]() 在水中的溶解度与温度的关系如图所示。由
在水中的溶解度与温度的关系如图所示。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
(6)已知:![]() 。室温下,若溶液中
。室温下,若溶液中![]() ,欲使溶液中的
,欲使溶液中的![]() ,则需调节溶液pH范围为______________________。
,则需调节溶液pH范围为______________________。
【题目】I。草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生反应:
(实验1)甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 | KMnO4溶液 /mL | H2C2O4溶液 /mL | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(1)写出草酸(H2C2O4)与高锰酸钾溶液在酸性条件下反应的离子方程式________。
(2)上述进行实验Ⅰ、Ⅲ的目的是探究__________对化学反应速率的影响。
(实验2)乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_______的影响。
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是____(填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
Ⅱ.用如图所示的装置进行中和热的测定实验,分别取![]() 的
的![]() 溶液、
溶液、![]() 的硫酸进行实验,回答下列问题:
的硫酸进行实验,回答下列问题:
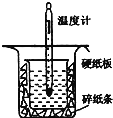
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为![]() 的NaOH溶液和
的NaOH溶液和![]() 的硫酸溶液的密度都是
的硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)上述实验数值结果与![]() 有偏差,产生偏差的原因可能是(填字母)_____。
有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定![]() 溶液起始温度后直接测定H2SO4溶液的温度
溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把![]() 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值