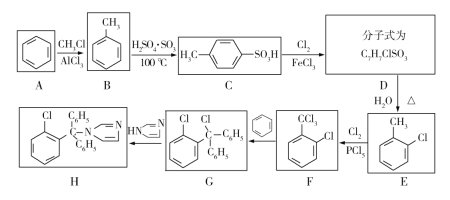
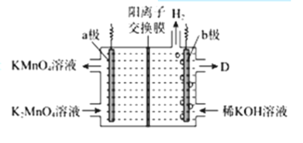
题目内容
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
【答案】d ![]() Cl 弱 ③
Cl 弱 ③
【解析】
表中六种元素都为短周期元素,则a,b,c为第二周期元素,且三元素在周期表中左右相邻;d,e,f为第三周期元素,且三元素在周期表中左右相邻,在进行元素性质分析时,可将元素在周期中进行定位,也可利用金属性和非金属的分界进行判断。
(1)六种元素中,原子半径最大的元素是电子层数多,同周期元素从左到右半径减小,半径最大的元素位于左下方,即为d;
(2)若a的气态氢化物的水溶液呈碱性,为氨气,氮的最外层有5个电子,与三个氢原子形成三对共用电子对,剩余一对孤对电子,氨气的电子式:![]() ,当a为N元素时,b为O,c为F,d是P,e是S,f是Cl,这些元素中,非金属性最强的是Cl,最高价氧化物对应的水化物酸性最强的是HClO4;
,当a为N元素时,b为O,c为F,d是P,e是S,f是Cl,这些元素中,非金属性最强的是Cl,最高价氧化物对应的水化物酸性最强的是HClO4;
(3)若f元素的原子L层电子数比M层电子数多1个,则f为Cl,e为S,非金属性则S元素的非金属性比Cl元素的非金属性弱;
(4)若b为非金属元素,依据金属性和非金属性的分界线进行判断,c和f一定是非金属元素,
①a位于b的前面,可能是金属元素,也可能是非金属元素,故①错误;
②d位于b的左下方,可能是金属元素,也可能是非金属元素,故②错误;
③若b为非金属元素,f位于它的对角线位置,一定是非金属元素,故③正确。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: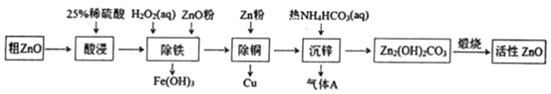
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O