题目内容
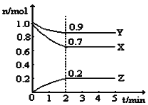
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
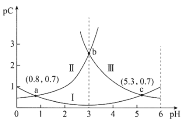
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
【答案】C
【解析】
A.曲线II为PC(H2C2O4),曲线I为PC(HC2O4-)、III为PC(C2O42-),当pH=0.8时,PC(H2C2O4)=PC(HC2O4-),即c(H2C2O4)=c(HC2O4-),则Ka1=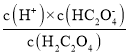 =c(H+) =10-0.8,故A错误;
=c(H+) =10-0.8,故A错误;
B.曲线II为PC(H2C2O4),曲线I为PC(HC2O4-)、III为PC(C2O42-),pH=3时,PC(H2C2O4)=PC(C2O42-)>PC(HC2O4-),pC越小则该微粒浓度越大,所以c(HC2O3-)>c(C2O42-)=c(H2C2O4),故B错误;
C.酸抑制水电离,酸中c(H+)越大其抑制水电离程度越大,所以pH从0.8上升到5.3的过程中c(H+)减小,则水的电离程度增大,故C正确;
D. ,电离平衡常数只与温度有关,温度不变则
,电离平衡常数只与温度有关,温度不变则![]() 不变,故D错误;
不变,故D错误;
故答案为C。

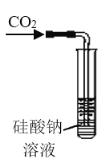
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
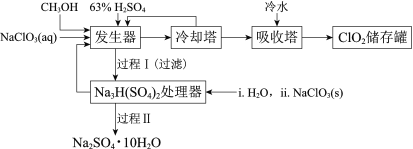
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
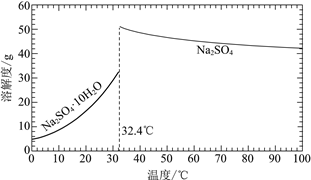
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。