题目内容
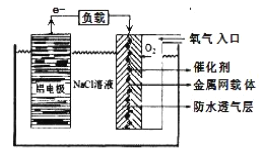
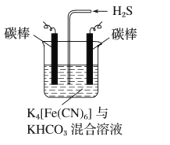
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJmol-1.如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a上发生的电极反应为:2H2S-4e-=S2+4H+
B.电池工作时,电流从电极a经负载流向电极b
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
【答案】A
【解析】
该装置为电池,a电极中H2S→S2,S的化合价升高,根据原电池的工作原理,该电极为负极,b电极为正极,据此分析;
A. 根据装置图,电极a上S的化合价由-2价→0价,化合价升高,即电极a为负极,交换膜为质子固体电解质膜,该电极反应式为2H2S-4e-=S2+4H+,故A正确;
B. 根据选项A的分析,电极a为负极,电极b为正极,电流从电极b经负载流向电极a,故B错误;
C. 该装置为原电池装置,化学能大部分转化成电能,少量转化成热能,即故C错误;
D. 根据原电池工作原理,H+向正极区移动,故D错误;
答案:A。

【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素