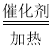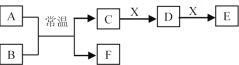题目内容
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
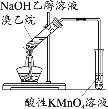
A. 配制FeCl3溶液
配制FeCl3溶液
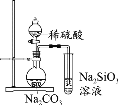
B. 酯水解程度比较
酯水解程度比较
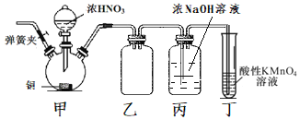
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D. 卤化银沉淀的转化
卤化银沉淀的转化
【答案】B
【解析】
A. Fe3+发生水解:Fe3++3H2O![]() Fe(OH)3+3H+,将FeCl3溶于浓盐酸中,可以抑制Fe3+水解,能够用勒夏特列原理解释,故A不符合题意;
Fe(OH)3+3H+,将FeCl3溶于浓盐酸中,可以抑制Fe3+水解,能够用勒夏特列原理解释,故A不符合题意;
B. 酯的水解中,稀硫酸作催化剂,催化剂不影响平衡,不能用勒夏特列原理解释,故B符合题意;
C. 碳酸钙与盐酸反应生成CO2,CO2在水中存在溶解平衡,塞上瓶塞时,压强增大,促进CO2的溶解,不会有气泡生成,打开瓶塞后压强减小,生成气泡,,可用勒夏特列原理解释,故C不符合题意;
D. AgNO3与NaCl发生AgNO3+NaCl=AgCl↓+NaNO3,NaCl过量,AgNO3完全反应,AgCl在溶液中存在溶解平衡,加入少量的KI溶液后生成黄色沉淀,该沉淀为AgI,说明实现了沉淀的转化,能够用勒夏特列原理解释,故D不符合题意;
答案:B。

练习册系列答案
相关题目
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素