题目内容
11. 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断A.T1<T2,P1>P2(填“>”“<”或“=”)
B.正反应是放热反应.(填“放热”或“吸热”)
C.增大压强,平衡朝逆反应移动(填“正反应”“逆反应”或“不”)
D.该条件下,L的状态气态.
分析 A.根据温度、压强对平衡移动的影响分析,温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大;
B.根据温度增大,平衡向吸热方向判断;
C.增大压强向计量数减小的方向移动;
D.根据改变压强对平衡的影响分析.
解答 解:A.温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大,
已知T2条件下,P1时反应先到达平衡,则P1 >P2;P2条件下,T2时反应先到达平衡,则T2>T1,
故答案为:<;>;
B.由A分析可知,T2时温度高,温度越高,R的含量越低,则升高温度平衡逆向移动,则逆方向为吸热方向,正方向为放热方向,即为放热反应;
故答案为:放热;
C.增大压强向计量数减小的方向移动,已知P1 >P2,温度相同时,压强越大,R含量越小,则增大压强向逆方向移动;
故答案为:逆反应;
D.已知P1 >P2,温度相同时,压强越大,R含量越小,则增大压强向逆方向移动,所以逆方向为体积减小的,即1+1<1+2,所以L为气体;
故答案为:气态.
点评 本题考查了温度、压强对化学平衡的影响,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强与生成物C物质的量的变化确定反应热及气体的计量数变化,难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
10.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标志是:(分别用V表示正反应速率,V╯表示逆反应速率)( )
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
19.1mol乙烷与3molCl2在光照条件下反应,理论上得到的氯代物有( )
| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |
6.能说明氯的非金属性比硫强的事实是( )
| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
16.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
| A. | 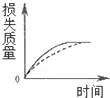 | B. |  | C. | 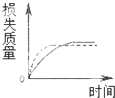 | D. | 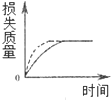 |
20.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
1.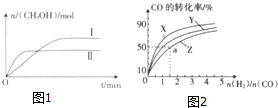 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,则:
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
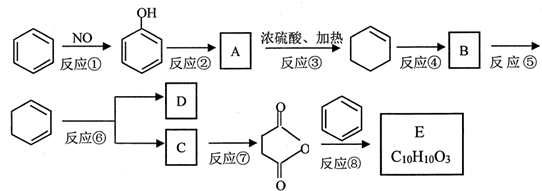
 +(CH3CO)2O→
+(CH3CO)2O→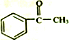 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.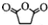 +
+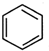 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$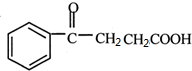 .
. 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.