题目内容
6.下列说法正确的是( )| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 植物油和裂化汽油可用溴水鉴别 | |
| D. | 在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
分析 A.聚乙烯不含不饱和键不能使溴的四氯化碳溶液褪色;
B.毛属于蛋白质,含有N元素;
C.碳碳双键能和溴发生加成反应而使溴水褪色;
D.蛋白质遇到浓硝酸会发生变性.
解答 解:A.乙烯含有碳碳双键与溴发生加成反应,使溴的四氯化碳溶液褪色,聚乙烯不含不饱和键不能使溴的四氯化碳溶液褪色,故A错误;
B.毛属于蛋白质,含有N元素,燃烧产物不只是CO2和H2O,故B错误;
C.植物油和裂化汽油中都含有碳碳双键,都能和溴发生加成反应而使溴水褪色,所以不能鉴别,故C错误;
D.鸡蛋白溶液属于蛋白质,遇到浓硝酸会发生变性,鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质,故D正确.
故选D.
点评 本题考查有机物的检验,题目难度不大,注意根据有机物性质的异同选择鉴别方法,把握高分子化合物的特征.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
| A. | 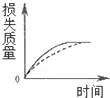 | B. |  | C. | 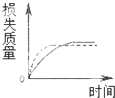 | D. | 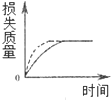 |
17.现有部分短周期元素的性质或原子结构如表:
(1)用化学用语回答下列问题:B元素在周期表中的位置第三周期第IA族;用电子式表示BD化合物的形成过程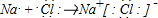 .
.
(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是ac(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经如下变化的过程转化(反应条件和个别生成物已略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为1:1.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
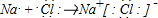 .
.(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是ac(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经如下变化的过程转化(反应条件和个别生成物已略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为1:1.
14. 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.
已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H
△H=△H2-△H1-2△H3.这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
下列判断正确的是BC.
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
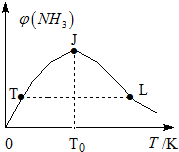
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是,JL段变化的主要原因是.氨气正反应速率:T点小于 L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
在该条件下,前5分钟H2平均反应速率为0.15mol•L-1•min-1.
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×107}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$
=32.2kW•h•kg-1(列式计算).
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H
△H=△H2-△H1-2△H3.这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是,JL段变化的主要原因是.氨气正反应速率:T点小于 L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×107}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$
=32.2kW•h•kg-1(列式计算).
1.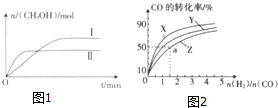 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,则:
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
11. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( ) | 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度大于2.5 mol•L-1 | |
| C. | 第2组实验中盐酸的浓度等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度低于30℃ |
18.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | B. | 水加热到1500℃开始分解 | ||
| C. | 熔融的氯化钠 | D. | NaOH溶于水 |
16.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | 正丁烷 | B. | 异丁烷 | C. | 甲烷 | D. | 丙烷 |
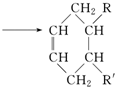 (可表示为
(可表示为 )其中,R、R′表示原子或原子团.
)其中,R、R′表示原子或原子团.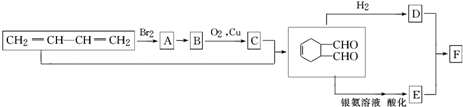
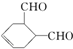 中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol
中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol .
.