题目内容
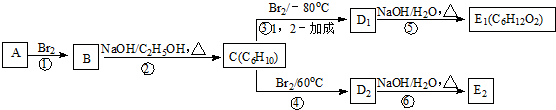
16.香料龙葵醛(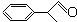 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: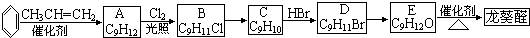
(1)龙葵醛的分子式为C9H10O,C中官能团的名称为碳碳双键.
(2)生成A的反应类型为加成反应,D→E的反应条件为NaOH的水溶液、加热
(3)写出下列E→龙葵醛的方程式:
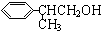 +O2
+O2
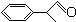 +2H2O.
+2H2O.(4)F是龙葵醛与新制Cu(OH)2反应后得到的物质,F有多种同分异构体,其中某些芳香族物质具有下列特征:①能发生银镜反应,也能与稀硫酸溶液反应;②是苯环的二元取代产物.则符合此条件的同分异构体共有6种,写出核磁共振氢谱有5种的物质的结构简式
 、
、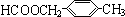 .
.
分析 根据苯和A的分子式知,苯和丙烯发生加成反应生成A,A为 ;
;
根据流程图知,从A到龙葵醛其中碳原子个数不变,E发生氧化反应生成龙葵醛,所以E结构简式为 ;D发生取代反应生成E,D为
;D发生取代反应生成E,D为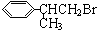 ;C发生加成反应生成D,则C为
;C发生加成反应生成D,则C为 ;A发生取代反应生成B,B结构简式为
;A发生取代反应生成B,B结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:根据苯和A的分子式知,苯和丙烯发生加成反应生成A,A为 ;
;
根据流程图知,从A到龙葵醛其中碳原子个数不变,E发生氧化反应生成龙葵醛,所以E结构简式为 ;D发生取代反应生成E,D为
;D发生取代反应生成E,D为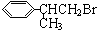 ;C发生加成反应生成D,则C为
;C发生加成反应生成D,则C为 ;A发生取代反应生成B,B结构简式为
;A发生取代反应生成B,B结构简式为 ,
,
(1)龙葵醛( )的分子式为C9H10O,C为
)的分子式为C9H10O,C为 ,C中官能团的名称为碳碳双键,
,C中官能团的名称为碳碳双键,
故答案为:C9H10O;碳碳双键;
(2)由苯环与A的分子组成差及转化关系知生成A的反应是加成反应,D是溴代烃、E是醇,D→E的反应条件为NaOH的水溶液、加热,
故答案为:加成反应;NaOH的水溶液、加热;
(3)E结构简式为 ,E发生氧化反应生成龙葵醛,则E→龙葵醛的方程式:2
,E发生氧化反应生成龙葵醛,则E→龙葵醛的方程式:2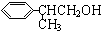 +O2
+O2
 +2H2O,
+2H2O,
故答案为: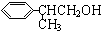 +O2
+O2
 +2H2O;
+2H2O;
(4)F是龙葵醛与新制Cu(OH)2反应后得到的物质,则F是异苯丙酸,F有多种同分异构体,其中某些芳香族物质具有下列特征:①能发生银镜反应,也能与稀硫酸溶液反应说明为甲酸某酯;②是苯环的二元取代产物,说明含有两个取代基,两个取代基分别是:“HCOO-、-CH2CH3或HCOOCH2-、-CH3”,两个取代基在苯环上存在邻位、间位、对位三种位置关系,故共有6种同分异构体;其中核磁共振氢谱有5种的物质是: 、
、 ,
,
故答案为:6; 、
、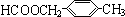 .
.
点评 本题考查有机物推断,为高频考点,涉及烃、卤代烃、醇、醛、羧酸之间的转化,侧重考查分析推断能力,根据反应条件、分子式变化确定反应类型及物质结构简式,采用正逆结合的方法进行推断,难点是同分异构体种类判断,注意甲酸某酯能发生银镜反应,题目难度不大.

| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(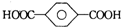 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (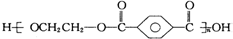 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
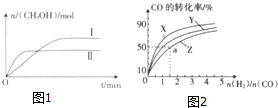 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
①
 ②
② ③
③ ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ④和⑧ | B. | ①②和③ | C. | ⑦和⑧ | D. | ④⑥和⑧ |
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
| A. | 碳酸钙和醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氢氧化镁与硫酸溶液反应 H++OH-=H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ | |
| D. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
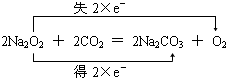 .
.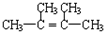 ;
;
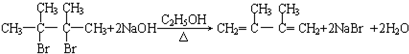 ;
;