题目内容
7.某同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究.Ⅰ、探究硫酸的性质
(1)某同学设计如图1装置(夹持和加热装置略)拟完成有关实验.但该装置在设计上存在明显的安全隐患是装置乙不应有瓶塞
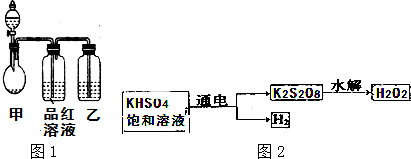
(2)将上述装置改进确认不存在安全隐患并检验气密性后,将铜片放入圆底烧瓶中,通过分液漏斗向圆底烧瓶中滴加足量的浓硫酸,加热圆底烧瓶,充分反应后,观察到圆底烧瓶铜片不断溶解,但有铜片剩余,圆底烧瓶溶液呈蓝色,盛品红溶液的试剂瓶中溶液颜色褪去.回答下列问题:
①圆底烧瓶中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②装置乙中的试剂是氢氧化钠溶液.
(3)从装置中取下圆底烧瓶,向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶.观察到圆底烧瓶中的红色固体逐渐溶解并完全消失.此时发生反应的离子方程式为
2Cu+O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O
(4)若要用(3)问所得溶液来制备硫酸四氨合铜晶体,其操作是在烧瓶中先加入氨水到溶液呈深蓝色,再加乙醇,至析出深蓝色晶体,再过滤.
Ⅱ、用KHSO4制取H2O2并测其物质的量浓度.
(1)工业上电解KHSO4饱和溶液制取H2O2的示意图如图2(已知:KHSO4=K++H++SO42-):
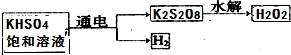
电解饱和KHSO4溶液时反应的离子方程式2H++2SO42-$\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑.
(2)测定H2O2的物质的量浓度:
①取20.00mL上述已制得的H2O2溶液置于锥形瓶中,加稀硫酸酸化 ②用0.1000mol/LKMnO4溶液滴定 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,原H2O2溶液中H2O2的物质的量浓度为0.25mol/L.(已知:滴定时该反应的还原产物是Mn2+,氧化产物是O2)
分析 Ⅰ.(1)装置乙有瓶塞,无法与大气相通,则多余的二氧化硫无法被吸收;
(2)①圆底烧瓶中铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
②二氧化硫有毒,多余的气体需要吸收,二氧化硫能够与氢氧化钠溶液反应从而吸收吸收二氧化硫;
(3)向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶,铜与氧气反应生成氧化铜,氧化铜与氢离子反应生成铜离子,则会观察到圆底烧瓶中的红色固体逐渐溶解并完全消失,据此写出反应的总离子方程式;
(4)向溶液中先加入过量氨水,反应生成硫酸四氨合铜,然后加入乙醇,由于硫酸四氨合铜乙醇中溶解度较小,所以会形成硫酸四氨合铜晶体,最后过滤即可,
Ⅱ.(1)阳极是阴离子失电子发生氧化反应,阴极得到电子生成氢气,据此写出电极反应式;
(2)计算出三次消耗KMnO4溶液的平均体积,再计算出消耗高锰酸根离子的物质的量,然后根据反应方程式计算出消耗双氧水的物质的量,最后根据c=$\frac{n}{V}$计算出浓度.
解答 解:Ⅰ.(1)装置乙中有瓶塞,当气压达到一定程度时,这样产生的尾气不会进入瓶中,达不到尾气处理装置,
故答案为:装置乙不应有瓶塞;
(2)①圆底烧瓶中铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,发生反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②二氧化硫有毒,多余的气体需要吸收,二氧化硫能够与氢氧化钠溶液反应,所以装置乙中可以为氢氧化钠溶液,
故答案为:氢氧化钠液;
(3)从装置中取下圆底烧瓶,向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶,铜与氧气反应生成氧化铜,氧化铜与氢离子反应生成铜离子,则会观察到圆底烧瓶中的红色固体逐渐溶解并完全消失,反应的总离子方程式为:2Cu+O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O,
故答案为:2Cu+O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O;
(4)所带溶液为硫酸铜溶液,向溶液中先加入过量氨水,反应生成硫酸四氨合铜,然后加入乙醇,由于硫酸四氨合铜乙醇中溶解度较小,所以会形成硫酸四氨合铜晶体,最后过滤就可以得到硫酸四氨合铜,
故答案为:在烧瓶中先加入氨水到溶液呈深蓝色,再加乙醇,至析出深蓝色晶体,再过滤;
Ⅱ.(1)电解饱和KHSO4溶液时,阳极是阴离子发生失电子的氧化反应,阴极氢离子得到电子生成氢气,总电极反应式为:2H++2SO42- $\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑,
故答案为:2H++2SO42- $\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑;
(2)三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,则体积平均值为:20.00mL,则消耗高锰酸根的量:0.1mol/L×0.02L=0.002mol,设双氧水的物质的量为n,则
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2 5
0.002mol n
解得:n=0.005mol,
双氧水的物质的量浓度为:$\frac{0.005mol}{0.02L}$=0.25mol/L,
故答案为:0.25mol/L.
点评 本题考查了性质实验方案的设计、探究物质组成及含量,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识解决实际问题的能力,注意掌握性质实验方案的设计与评价原则.

| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 油酸和水、甲苯和水、己烷和苯 |
| A. | 增大压强 | B. | 降低温度 | ||
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
| A. | 氯原子的结构示意图: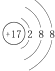 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
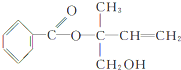 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |