题目内容
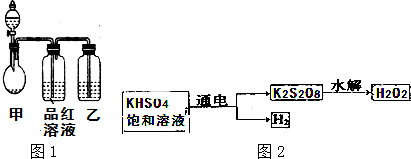
2.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.请回答:
(1)装置A中发生的化学反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是氢氧化钠溶液等碱性溶液,其作用是吸收多余的二氧化硫,防止污染空气
(3)装置B的作用贮存多余气体.当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升,B中应放置的液体是(填字母)d
a.水 b.酸性KMnO4溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同,C中是由于SO2与氢氧化钠溶液反应使酚酞试液变为无色,反应的离子方程式为SO2+2OH-=SO32-+H2O.
分析 (1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收;
(3)装置B通过长颈漏斗中液面变化贮存二氧化硫;B为气体贮存装置时,盛放的液体不能和二氧化硫反应;
(4)二氧化硫属于酸性氧化物,能和碱反应生成盐和水;二氧化硫能和有色物质反应生成无色物质而具有漂白性.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液;其作用是吸收多余的二氧化硫,防止二氧化硫溢出而污染大气,
故答案为:氢氧化钠溶液等碱性溶液;吸收多余的二氧化硫,防止污染空气;
(3)可以通过B装置中长颈漏斗中液面上升来贮存二氧化硫;
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;
B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,
水、酸性高锰酸钾及NaOH都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,故选d;
故答案为:贮存多余气体;瓶中液面下降,长颈漏斗中液面上升;d;
(4)无色酚酞遇碱变红色,二氧化硫属于酸性氧化物,能和NaOH反应生成亚硫酸钠和水,导致酚酞褪色;二氧化硫和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,所以二者褪色原理不同,二氧化硫和氢氧化钠离子反应方程式为SO2+2OH-=SO32-+H2O,
故答案为:与氢氧化钠溶液反应使酚酞试液变为无色;SO2+2OH-=SO32-+H2O.
点评 本题以浓硫酸和Cu的反应为载体考查性质实验方案设计,侧重考查学生分析判断、实验操作能力,明确实验原理是解本题关键,注意CD溶液褪色原理及其不同点,注意二氧化硫不能使酸碱指示剂褪色.

| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
| A. | 硫酸钾:KSO4 | B. | 过氧化钠:Na2O2 | C. | 一氧化氮:N2O | D. | 水:H2O2 |
| A. | CH2═CHCH3 | B. | CH3CH═CHCH3 | C. | (CH3)2C═C(CH3)2 | D. | CH3CH2CH═CH2 |
| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
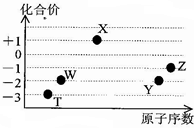 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
下列说法不正确的是( )
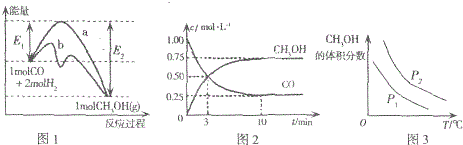
| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
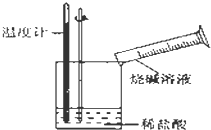 某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.
某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.