题目内容
12.工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).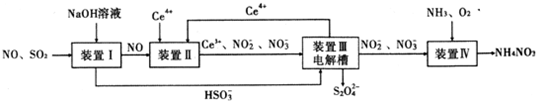
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式NO+H2O+Ce4+=Ce3++NO2-+2H+.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
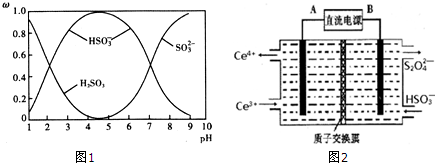
①下列说法正确的是BCD(填标号).
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=2和 pH=9时的溶液中所含粒子种类不同
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O.
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在酸式(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变.
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.
图中A为电源的正(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
(4)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为4480 L.
分析 装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(2)①A.pH=7时,溶液为中性,结合电荷守恒分析;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- );
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大;
D.由图可知,pH=2时,C(HSO3-)=C(H2SO3),pH=9时溶液,溶液为亚硫酸钠溶液;
②NaOH的物质的量为1mol,根据2NaOH+SO2═Na2SO3+H2O可知二氧化硫过量,过量部分的二氧化硫再发生反应Na2SO3+H2O+SO2═2NaHSO3,依据方程式进行计算n(SO32-):n(HSO3-)的比,据此书写离子方程式;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液;酸性高锰酸钾具有强氧化性,能氧化碱式滴定管橡皮管;原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上;反应物是HSO3-被还原成S2O42-,得到电子;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,设消耗标况下氧气的体积是V,结合电子守恒进行计算;
解答 解:装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-,
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A错误;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.由图可知,pH=2时,C(HSO3-)=C(H2SO3),溶液为亚硫酸、亚硫酸氢钠溶液,pH=9时溶液,溶液为亚硫酸钠溶液,两种溶液中所含粒子种类不同,故D正确;
故答案为:BCD;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
$\frac{2}{1.0mol}$=$\frac{1}{y}$=$\frac{1}{x}$解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
$\frac{1}{a}$=$\frac{2}{b}$=$\frac{1}{0.3mol}$解得:a=0.1mol b=0.2mol,
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:$\frac{VL}{22.4L/mol}$×4=1000×(5-3)×0.4mol,解得V=4480L,
故答案为:4480.
点评 本题考查电工业生产中化学原理吸收SO2和NO的工艺,为高频考点,涉及氧化还原反应、离子浓度比较、电化学等,综合性强,侧重分析、计算能力的考查,题目难度较大.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 1和6 | B. | 1和7 | C. | 2和6 | D. | 2和7 |
| A. | 元素周期表含元素最多的族是第ⅢB族 | |
| B. | 元素周期表有18个族 | |
| C. | 第ⅠA族的元素全部是金属元素 | |
| D. | 长周期是指第四、五、六周期 |
| A. | 2014年诺贝尔化学奖授予发明超分辨屏荧光显微镜的科学家,他们使光学显微镜分屏率提高到纳米尺度.利用超分辨率荧光显微镜可以观察到胶体中的胶粒 | |
| B. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排除体外 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国四汽油升级到国v汽油,有助于减少酸雨、雾霾,提高空气质量 |
| A. | 含氢氧化铁胶粒的分散系中可能大量存在H+,K+,S2-Br- | |
| B. | 高锰酸钾溶液中可能大量存在H+,Na+,SO42-,葡萄糖分子 | |
| C. | 弱碱性溶液中可能大存在Na+,K+,Cl-,HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+,K+,Cl-,SO42- |
| A. | 3种 | B. | 6种 | C. | 12种 | D. | 18种 |
 .
. .
. 、
、