题目内容
16.新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氧的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):①CH3OCH3(g)+H2O(l)?2CH3OH(l)△H=+24.5kJ/mol
②CH3OH(l)+H2O(l)?CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)?CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)?CO(g)+2H2(g)△H=+90.18kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式CH3OCH3(g)+3H2O(l)?CO2(g)+3H2(g)△H=+122.52KJ/mol.
(2)200℃时反应③的平衡常数表达式K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$.
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为A.
A、容器内气体密度保持不变
B、气体的平均相对分子质量保持不变
C、CO的体积分数保持不变
D、CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如图1所示.
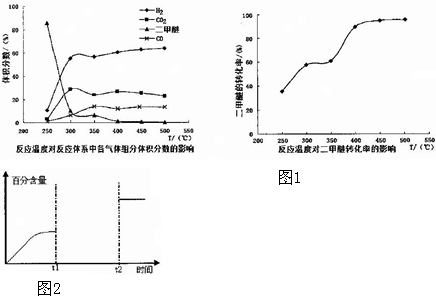
①你认为反应控制的最佳温度为C.
A、300~350℃B、350~400℃C、400~450℃D、450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是可能发生另一种制氢反应:CH3OCH3+CO2?3H2+3CO.(用相应的化学方程式表示)
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡.请在图2中补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图象.
分析 (1)依据盖斯定律解答,从待求反应出发,分析已知反应的反应物和生成物,通过相互加减得到待求反应;
(2)根据平衡常数表达式等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;
(3)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据密度和平均相对分子质量的公式进行分析解答该题;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,据此画图.
解答 解:(1)已知
①CH3OCH3(g)+H2O(l)?2CH3OH(l)△H=+24.5kJ/mol
②CH3OH(l)+H2O(l)?CO2(g)+3H2(g)△H=+49.01kJ/mol
据盖斯定律,①+②×2得:CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g)△H=+24.5kJ/mol+49.01kJ/mol×2=+122.52KJ/mol;
故答案为:CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g)△H=+122.52KJ/mol;
(2)③200℃时CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.17kJ/mol,平衡常数表达式K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$,故答案为:$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$;
(3)A.在恒容容器中,体积不变,由CH3OH(l)?CO(g)+2H2(g)反应可得反应前后气体质量在变,所以密度保持不变,证明达到了化学平衡状态,故A正确;
B.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,则平均相对分子质量一直不变,所以平均相对分子质量保持不变不能证明达到了化学平衡状态,故B错误;
C.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以CO的体积分数一直不变,所以CO的体积分数保持不变,不能证明达到了化学平衡状态,故C错误;
D.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以不能证明达到了化学平衡状态,故D错误.
故选:A;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故选C.
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO,故答案为:可能发生另一种制氢反应:CH3OCH3+CO2?3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为: ,故答案为:
,故答案为: ;
;
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡常数表达式的书写、平衡状态的判断图表信息的提取与应用,综合性强,难度不大.

| A. | 大部分蔬菜和水果属于碱性食物 | B. | 大米和面粉属于酸性食物 | ||
| C. | 牛奶遇碘水变蓝色 | D. | 鸡蛋和牛奶含有较多蛋白质 |
| A. | 含氢氧化铁胶粒的分散系中可能大量存在H+,K+,S2-Br- | |
| B. | 高锰酸钾溶液中可能大量存在H+,Na+,SO42-,葡萄糖分子 | |
| C. | 弱碱性溶液中可能大存在Na+,K+,Cl-,HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+,K+,Cl-,SO42- |
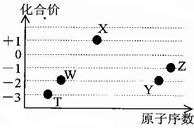 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
| A. | 3种 | B. | 6种 | C. | 12种 | D. | 18种 |
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |