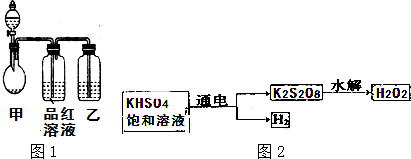
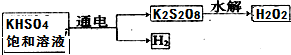
题目内容
16.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 油酸和水、甲苯和水、己烷和苯 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,一般来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂.
解答 解:A.乙酸乙酯和水不溶,苯酚和水不溶,能用分液漏斗进行分离,酒精和水互溶,不能用分液漏斗进行分离,故A错误;
B.二溴乙烷和水,溴苯和水,硝基苯和水,不互溶,都能用分液漏斗进行分离,故B正确;
C.甘油和水、乙醛和水、乙酸和乙醇互溶,不能用分液漏斗进行分离,故C错误;
D.油酸和水,甲苯和水互溶,己烷和苯互溶,不能用分液漏斗进行分离,故D错误.
故选B.
点评 本题考查了物质分离方法中的分液法,熟记物质的性质是解题的关键所在,难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
6.下列说法中,正确的是( )
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
11.下列说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
1.化学式为C5H12O2的二元醇有多种同分异构体.其中主链上有3个碳原子和主链上有4个碳原子的二元醇,其同分异构体数目分别是(不包括1个碳原子上连接2个羟基的化合物)( )
| A. | 1和6 | B. | 1和7 | C. | 2和6 | D. | 2和7 |
8.等质量的两种烃完全燃烧,若生成CO2与消耗O2的量均相等,则这两种烃之间的关系正确的是( )
| A. | 一定互为同分异构体 | B. | 一定是同系物,有相同的通式 | ||
| C. | 实验式相同 | D. | 只能是同种物质 |
5.下列说法不正确的是( )
| A. | 大部分蔬菜和水果属于碱性食物 | B. | 大米和面粉属于酸性食物 | ||
| C. | 牛奶遇碘水变蓝色 | D. | 鸡蛋和牛奶含有较多蛋白质 |