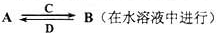题目内容
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):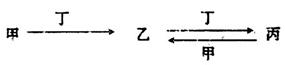
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示: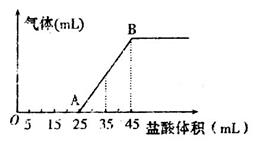
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
(1)①硫氰酸钾 ②bd ③常温下,铁在硝酸中钝化
(2)①bc ②OH-+H+=H2O CO32-+H+= HCO3- 0.1mol/L
解析试题分析:
(1)无色气体遇到空气变成红棕色可知,丁为硝酸,从题目关系图可知,金属甲为Fe。丙溶液中金属阳离子为Fe3+,可用KSCN,检验。n mol丁的稀溶液和m mol单质甲,二者恰好完全反应,设生成xmolNO。用极值法解决,若Fe完全被氧化成Fe3+,则存在x=m,n(NO)+n(NO3-)=n,即n:m=4:1。若Fe完全被氧化成Fe2+,则存在2m=3x,n(NO)+n(NO3-)=n,即n:m=8:3,所以8/3≤n/m≤4,选bd。
③Fe遇到浓硝酸和浓硫酸会发生钝化。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。则甲为NaOH,丙为NaHCO3,乙为Na2CO3。NaHCO3和 Na2CO3用氯化钙鉴别时Na2CO3生成沉淀,NaHCO3无现象。用硫酸鉴别时,前者立即产生气体,后者开始无明显现象,滴定一段时间后产生气体。
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,H+先与OH-,再与CO32-,生成HCO3-,最后与HCO3-反应生成气体。OA段为H++OH-==H2O,CO32- + H+=HCO3-加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则n(H2)=0.001mol, H+和HCO3-反应的物质量之比为1:1.则盐酸的物质的量浓度为0.1mol/L。
考点:元素及其化合物的性质

 导学教程高中新课标系列答案
导学教程高中新课标系列答案同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是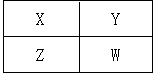
| A.非金属性:Z<X<Y |
| B.W的原子序数可能是Y的原子序数的2倍 |
| C.气态氢化物稳定性:Y<W |
| D.四种元素中不可能有金属元素 |

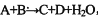 ;请回答下列问题:
;请回答下列问题: