题目内容
【题目】某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
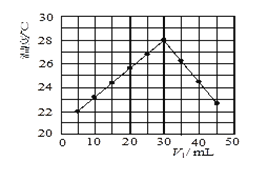
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22 ℃,判断的依据是____________
(2)由题干及图形可知,V1/V2=__________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为___________mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:____________
【答案】低于 从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃ ![]() 1.5 HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=
1.5 HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=![]()
【解析】
(1).考虑中和反应是放热反应;
(2).当酸碱恰好反应时,放出的热量最高,从图示可知二者体积比,根据反应关系计算氢氧化钠的浓度;
(3)根据![]() 计算出△H,根据化学计量数和△H关系写出热化学方程式。
计算出△H,根据化学计量数和△H关系写出热化学方程式。
(1)从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22 ℃;故答案为:低于;从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃;
(2)当酸碱恰好反应时,放出的热量最高,从图示可知V1=30mL,V2=50mL-30mL=20mL,二者体积比为:![]() ,
,![]() ,故答案为:
,故答案为:![]() ;1.5;
;1.5;
(3)20mL1.5mol/L氢氧化钠与30mL1.0mol/L盐酸溶液进行中和反应生成水的物质的量为:0.02L ×1.50mol/L = 0.03mol ,△H=![]() ,故答案为:HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=
,故答案为:HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=![]() 。
。

【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D