题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后达平衡状态,此时测得D的浓度为0.5mol/L,混合气体的总体积为134.4L(标准状况),C的平均反应速率为0.1mol/(L·min)。试求:
(1)此时C的浓度c(C)=__________mol/L,x的值为___________;
(2)反应开始前容器中的A.B的物质的量:n(A)=n(B)=________mol;
(3)A的平均反应速率为___________
【答案】0.5 2 3 ![]()
【解析】
(1)根据化学反应速率计算公式及反应速率之比等于方程式计量数之比解答;
(2)根据平衡时的混合气体的总体积解答;
(3)根据化学反应速率计算公式解答。
(1) C的平均反应速率为0.1mol/(L·min),根据公式![]() ,则C的浓度
,则C的浓度![]() ;由于5min后,测得D的浓度为0.5mol/L,则x=2,故答案为:0.5;2;
;由于5min后,测得D的浓度为0.5mol/L,则x=2,故答案为:0.5;2;
(2)将等物质的量的A、 B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L= 1mol,则:
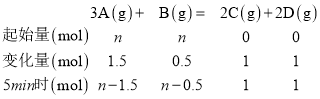
经5min后达平衡状态,混合气体的总体积为134.4L(标准状况),即混合气体的物质的量为:![]() ,即n-1.5+n-0.5+1+1=6mol,n(A)= n(B)= 3mol,故答案为:3;
,即n-1.5+n-0.5+1+1=6mol,n(A)= n(B)= 3mol,故答案为:3;
(3)根据公式![]() 有:
有: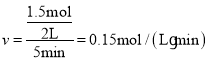 ,故答案为:
,故答案为:![]() 。
。

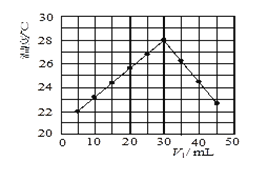
【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |

下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320
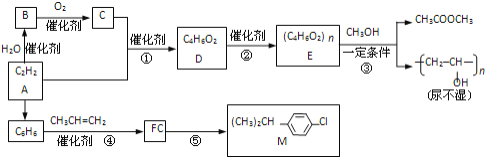
【题目】一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
(1)已知:①C2H4(g)+2O2(g)=2CO2(g)+2H2(g) ΔH1
②2H2(g)+O2(g)=2H2O(1) ΔH2
③H2O(1)=H2O(g) ΔH3
④2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH4
C2H4(g)+4H2O(g) ΔH4
则ΔH4=___(用ΔH1、ΔH2、ΔH3表示)。
(2)反应④的反应温度、投料比[![]() =x]对CO2平衡转化率的影响如图所示。
=x]对CO2平衡转化率的影响如图所示。
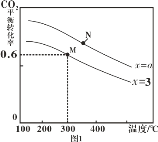
①a__3(填“>”、“<”或“=”);M、N两点反应的平衡常数KM__KN(填填“>”、“<”或“=”)
②M点乙烯体积分数为__;(保留2位有效数字)
③300℃,往6L反应容器中加入3molH2、1molCO2,反应10min达到平衡。求0到10min氢气的平均反应速率为__;
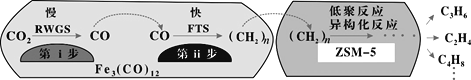
(3)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率 (%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加__助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__;
②下列说法正确的是__;
a.第ⅰ步所反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
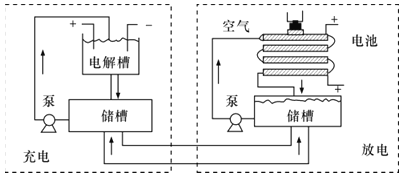
(4)2018年,强碱性电催化还原CO2制乙烯研究取得突破进展,原理如图所示。
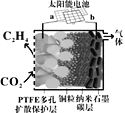
①b极接的是太阳能电池的__极;
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式__。
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
(1)实验①反应后的溶液pH=9的原因是___(用离子方程式表示)。
(2)实验①和实验②中水的电离程度较大的是__,该溶液中由水电离出的c(OH-)=__。
(3)x__0.2(填“>”“<”或“=”),若x=a,则室温下HA的电离平衡常数Ka=__(用含a的表达式表示)。
(4)若用已知浓度的KOH滴定未知浓度的一元酸HA,滴定终点的判断方法是__。