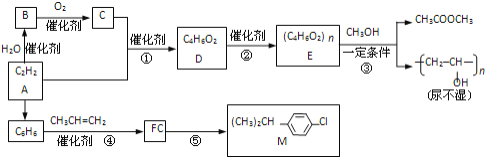
题目内容
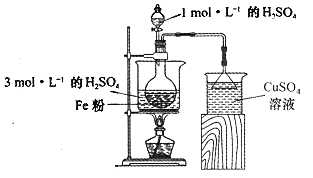
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:
①Na2S+H2O+SO2→Na2SO3+S
②2H2S+SO2→3S↓+2H2O
③S+Na2SO3![]() Na2S2O3
Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________________,则整个装置气密性良好。装置D的作用是_________。装置E中为_________溶液。
(2)装置B可用于观察SO2的生成速率,其中的液体最好选择_________。
a.饱和食盐水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是__________。
(3)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_________________。
(4)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_________(Na2S2O3·5H2O式量248)
【答案】一段时间内保持不变 防倒吸 NaOH c 溶液变澄清 加入盐酸,Na2S2O3反应S沉淀,所以静置后取上层清液,滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 0.64
【解析】
(1)利用液面差在一段时间内不变检验装置的气密性;有缓冲装置能防止倒吸;二氧化硫有毒不能直接排空,应该用碱液吸收;
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;观察SO2的生成速率,发生强酸制取弱酸的反应,为使SO2缓慢进入烧瓶C,应控制B中硫酸的加入速度,③中发生S(g)+Na2SO3(aq)=Na2S2O3(aq),反应达到终点是S完全溶解;
(3)检测产品中是否存在Na2SO4,先加盐酸排除干扰,再利用氯化钡检验硫酸根离子;
(4)根据产率=实际质量/理论质量×100%进行计算。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,说明不漏气,则气密性良好;D中左侧为短导管可防止液体倒吸;E中盛放NaOH溶液进行尾气处理,防止含硫化合物排放在环境中,从而保护环境;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;③中发生S(g)+Na2SO3(aq)=Na2S2O3(aq),反应达到终点是S完全溶解,可观察到溶液变澄清(或浑浊消失);
(4)检测产品中是否存在Na2SO4,取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质;
(5)由①Na2S+H2O+SO2→Na2SO3+H2S可知,0.08mol硫化钠生成0.08mol硫化氢和0.08mol亚硫酸钠,由②2H2S+SO2→3S↓+2H2O可知,0.08mol硫化氢反应生成0.12mol硫单质,由③S+Na2SO3=Na2S2O3可知,0.12mol硫单质生成0.12mol硫代硫酸钠,所以产率是![]() 。
。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
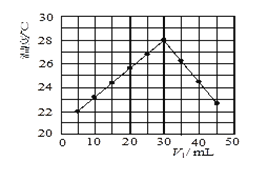
激活思维优加课堂系列答案【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
(1)实验①反应后的溶液pH=9的原因是___(用离子方程式表示)。
(2)实验①和实验②中水的电离程度较大的是__,该溶液中由水电离出的c(OH-)=__。
(3)x__0.2(填“>”“<”或“=”),若x=a,则室温下HA的电离平衡常数Ka=__(用含a的表达式表示)。
(4)若用已知浓度的KOH滴定未知浓度的一元酸HA,滴定终点的判断方法是__。