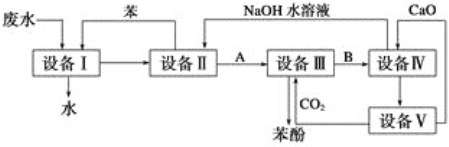
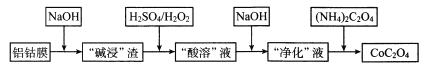
题目内容
【题目】下列有关说法中正确的是( )
A.100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏加德罗常数,下同)
B.3.1g白磷晶体中含有的P﹣P键数是0.6NA
C.向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO![]() +2H2O
+2H2O
D.冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键
【答案】D
【解析】
A.溶液中溶质和溶剂都含有氧原子,不要丢掉溶剂中的氧原子;
B.依据n=![]() 计算物质的量,白磷是正四面体结构,1个P4分子含6个P﹣P键;
计算物质的量,白磷是正四面体结构,1个P4分子含6个P﹣P键;
C.向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量,溶液中碳酸根离子全部转化为沉淀;
D.水分子间存在氢键。
A. 100g98%的硫酸溶液中含H2SO4 98g,物质的量为1mol,含有氧原子4mol,含水2g,含氧原子![]() mol,溶液中含有的氧原子数大于4NA, A错误;
mol,溶液中含有的氧原子数大于4NA, A错误;
B.白磷的分子式为P4,3.1g白磷晶体物质的量为![]() =0.025mol,P4分子是正四面体,1个P4分子含6个P﹣P键,分子中含有的P﹣P键数为0.025mol×6×NA=0.15NA,B错误;
=0.025mol,P4分子是正四面体,1个P4分子含6个P﹣P键,分子中含有的P﹣P键数为0.025mol×6×NA=0.15NA,B错误;
C.向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量,离子方程式为:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O,C错误;
D.水分子间存在氢键,分子间通过氢键结合形成较大的缔合分子,所以冰水中常会形成(H2O)x(x≥1)分子,D正确;
故选D。

【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
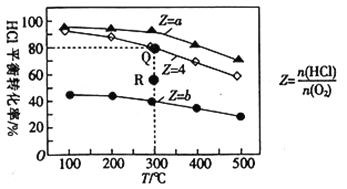
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320