题目内容
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、NH4+、Cl-、H+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有_________。
(2)第②步操作发生反应的离子方程式为_________。
(3)第③步操作确定的离子有_________。
(4)无法确定是否存在的离子是_________,若满足n(K+)________0.02mol(填“>”、“<”或“=”)时,能确定其存在。
【答案】H+、Ba2+ NH4++OH-![]() NH3↑+H2O CO32-、SO42- Cl- >
NH3↑+H2O CO32-、SO42- Cl- >
【解析】
由②中加入足量NaOH溶液后加热,收集到0.04mol气体,该气体为NH3,说明溶液中一定含NH4+,根据N元素守恒可知其物质的量n(NH4+)=0.04mol;
由③向第三份加入足量BaCl2溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤后,剩余2.33g可知,2.33g沉淀为BaSO4,6.27g>2.33g,沉淀用酸洗涤,质量减少,说明沉淀中有能够与盐酸反应的物质,说明沉淀中含有BaCO3,原溶液一定含SO42-和CO32-,与SO42-反应形成沉淀的Ba2+不能大量存在;与CO32-反应的H+不能大量存在;然后结合电荷守恒判断哪些离子存在与否,结合已知离子的物质的量,确定可能存在的离子的物质的量。
由②中加入足量NaOH溶液后加热,收集到气体0.04mol,该气体为NH3,溶液中一定含NH4+,其物质的量n(NH4+)=0.04mol;
由③向第三份加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余2.33g可知,2.33g沉淀为BaSO4,其物质的量n(BaSO4)= 2.33g÷233g/mol=0.01mol;则100mL溶液中含有沉淀中含SO42-物质的量n(SO42-)=n(BaSO4)=0.01mol;开始产生沉淀6.27g>2.33g,说明沉淀中有能够与盐酸反应的物质,沉淀为BaSO4和BaCO3的混合物,则原溶液一定含SO42-和CO32-,BaCO3与盐酸反应产生可溶性的BaCl2、H2O、CO2,BaCO3沉淀的质量为6.27g -2.33g=3.94g,则100mL溶液中含CO32-物质的量n(CO32-)=3.94g÷197g/mol=0.02mol。H+与CO32-反应,在原溶液不能大量存在H+;Ba2+与SO42-反应会反应产生BaSO4沉淀也不能大量存在;则原溶液中一定不能大量存在的离子有H+、Ba2+;由①知n(NH4+)=0.04mol,其带有的正电荷数:n(NH4+)×1=0.04mol×1=0.04mol,SO42-和CO32-带有的负电荷数2n(SO42-)+2n(CO32-)=2×0.01mol+2×0.02mol=0.06mol>0.04mol,说明在该溶液中还含有带正电荷的微粒,根据题干已知离子可知,还一定含有K+;若原溶液没有Cl-,则根据电荷守恒可知n(K+)=0.06mol-0.04mol=0.02mol;若溶液中含有Cl-,则根据电荷守恒可知溶液中K+的物质的量大于等于0.02mol。则①中加入AgNO3溶液有沉淀产生中一定含有Ag2SO4、Ag2CO3,可能含有AgCl。
综上所述可知:原溶液中一定含有SO42-、CO32-、NH4+、K+,一定不含有H+、Ba2+,可能含有Cl-。
则(1)一定不存在的离子有H+、Ba2+。
(2)第②步操作发生反应是NH4+与OH-反应产生NH3和水,反应的离子方程式为NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。
(3)第③步操作确定含有的离子有SO42-、CO32-。
(4)根据实验①现象判断,不能判断Cl-是否存在,;若K+的物质的量满足n(K+)>0.02mol时,能确定其存在,若n(K+)=0.02mol,则不存在Cl-。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
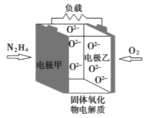
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
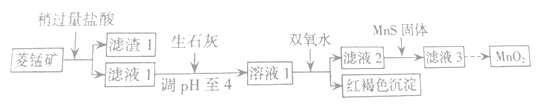
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的pH:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________;盐酸溶解MnCO3的离子方程式为___________;
(2)向溶液1中加入双氧水,反应的离子方程式是 ______________________________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- + ____ =______+ ____+ ____。
【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
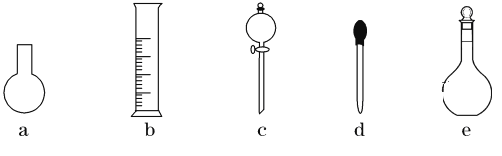
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)