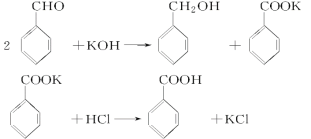
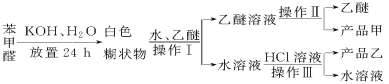
题目内容
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子交换法回收钒的新工艺,回收率达到91.7%。部分含钒物质在水中的溶解性如下表所示:

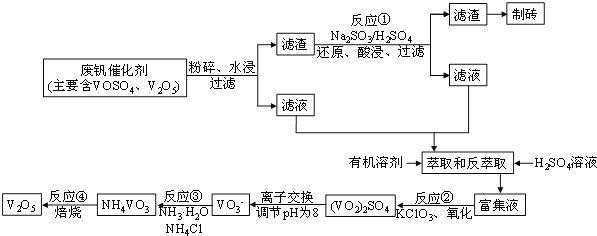
该工艺的主要流程如图所示:
![]()
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示____________,用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是________
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为_________________________
(3)若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O===3(VO2)2SO4+KCl+3H2SO4。若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12︰7,则废钒催化剂中VOSO4 和V2O5的物质的量之比为_____
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式_
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为:_________________
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O![]() V2++VO2++2H+
V2++VO2++2H+
①放电时的正极反应为_______________________
②充电时的阴极反应为______________________
【答案】3V2O5+10Al![]() 6V+5Al2O3 c V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O NH3·H2O 3︰2 NH4+ +VO3﹣===NH4VO3↓ 2VO2+ +H2C2O4+2H+===2VO2+ +2CO2↑+2H2O VO2++2H++e﹣===VO2++H2O V3++e﹣===V2+
6V+5Al2O3 c V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O NH3·H2O 3︰2 NH4+ +VO3﹣===NH4VO3↓ 2VO2+ +H2C2O4+2H+===2VO2+ +2CO2↑+2H2O VO2++2H++e﹣===VO2++H2O V3++e﹣===V2+
【解析】
废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5。
(1)由V2O5冶炼金属钒常用铝热剂法,其化学方程式为3V2O5+10Al![]() 6V+5Al2O3。物质与转移电子关系式为:a.
6V+5Al2O3。物质与转移电子关系式为:a.![]() Fe3O4~
Fe3O4~![]() e-~Fe;b.
e-~Fe;b.![]() Ni2O3~3e-~Ni;c.
Ni2O3~3e-~Ni;c.![]() V2O5~5e-~V;d.MnO2~4e-~Mn,由得失电子守恒可知,用铝热剂法从各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c;
V2O5~5e-~V;d.MnO2~4e-~Mn,由得失电子守恒可知,用铝热剂法从各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c;
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5转化为可溶性的VOSO4,便于提纯,则反应①的化学方程式为V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O;
(3)若反萃取使用硫酸用量过大,就需要用碱来中和,据流程图可知,进一步处理会增加NH3·H2O的用量,造成成本增大;
(4)假设两步所用试剂Na2SO3与KC1O3的物质的量为12mol:7mol,分别据两个方程式:
Na2SO3 + V2O5 + 2H2SO4 = 2VOSO4 + Na2SO4 + 2H2O
12mol 12mol 24mol
KClO3+6VOSO4+3H2SO4═3(VO)2(SO4)3+KCl+3H2O
7mol 42mol
该催化剂中VOSO4的物质的量为42mol-24mol=18mol,因此该催化剂中VOSO4、V2O5的物质的量之比为 18mol:12mol=3:2;
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,反应的离子方程式为NH4+ +VO3﹣===NH4VO3↓;
(6)用酸化的H2C2O4溶液滴定(VO2)2
(7)①正极反应是还原反应,由电池总反应可知放电时的正极反应为VO2++2H++e﹣===VO2++H2O;
②充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,电极反应为V3++e﹣===V2+。

【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
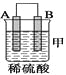
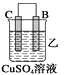
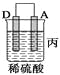
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。