题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
【答案】2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34.5kJ/mol 阴 2Cu-2e-+2OH-= Cu2O+H2O 增大 4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑
2Cu2O+6H2O+N2↑
【解析】
(1)根据盖斯定律并结合热化学方程式的书写方法来书写;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值的变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式。
(1)已知:①2Cu(s) +![]() O2(g)=Cu2O(s);△H= -169kJ/mol,
O2(g)=Cu2O(s);△H= -169kJ/mol,
②C(s)+![]() O2(g)=CO(g);△H= -110.5kJ/mol,
O2(g)=CO(g);△H= -110.5kJ/mol,
③Cu(s)+![]() O2(g)═CuO(s);△H= -157kJ/mol,
O2(g)═CuO(s);△H= -157kJ/mol,
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为2CuO(s)+C(s)=Cu2O(s)+CO(g),该反应可以由②-③×2+①得到,则反应的焓变为-110.5 kJ/mol –(-157 kJ/mol×2)-169 kJ/mol=34.5 kJ/mol;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度;在电解池中,铜电极连接电源的正极,则铜电极作阳极,且根据总反应式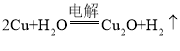 知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;
知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,依据得失电子守恒、元素守恒,写出化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑。
2Cu2O+6H2O+N2↑。

 备战中考寒假系列答案
备战中考寒假系列答案