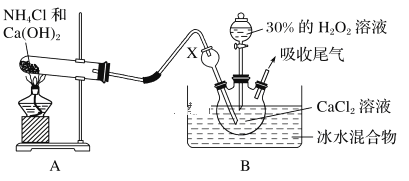
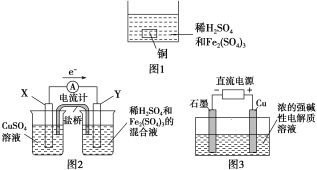
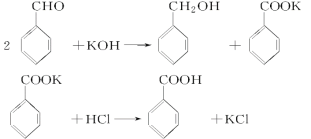
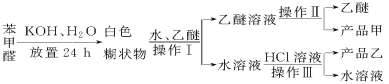
题目内容
【题目】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为_______、_________、___________
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有_________、________,将该化合物溶于水,得到常温下pH=a的溶液,此时水电离的c(H+)=________
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是______。此化合物在酸性条件下与高锰酸钾反应的离子方程式为______,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为:_______
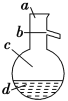
(4)有一瓶固体药品的标签被损坏了,残留部分如图,已知该固体溶于水呈碱性,请推测该固体的化学式可能是(写3种)______
【答案】H O Na NaOH Na2O2(或NaO2) 10-a mol/L H2O2 5H2O2+2MnO![]() +6H+===2Mn2++8H2O+5O2↑ H2O2+CN-+OH-===CO
+6H+===2Mn2++8H2O+5O2↑ H2O2+CN-+OH-===CO![]() +NH3 NaH、NaHCO3、NaHS
+NH3 NaH、NaHCO3、NaHS
【解析】
X原子形成的单质是密度最小的气体,则X为H;Y原子最外层电子数是其周期数的三倍,Y原子只能有2个电子层,最外层电子数为6,可推知Y为O;Z与X原子最外层电子数相同,则Z是钠。
(1)由分析可知,X、Y和Z的元素符号分别为H、O、Na;
(2)由H、O、Na元素组成的化合物中,既含有共价键又含有离子键的有NaOH(离子键和极性共价键)、Na2O2(离子键和非极性共价键),将该化合物溶于水,得到常温下pH=a的NaOH溶液,水的电离受到抑制,此时水电离的c(H+)=10-a mol/L;
(3)H、O组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2,过氧化氢的电子式为![]() 。H2O2在酸性条件下与高锰酸钾反应的离子方程式为5H2O2+2MnO
。H2O2在酸性条件下与高锰酸钾反应的离子方程式为5H2O2+2MnO![]() +6H+===2Mn2++8H2O+5O2↑,H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨的离子方程式为:H2O2+CN-+OH-===CO
+6H+===2Mn2++8H2O+5O2↑,H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨的离子方程式为:H2O2+CN-+OH-===CO![]() +NH3;
+NH3;
(4)残留部分如图且已知该固体溶于水呈碱性,推测该固体很可能为NaH或强碱弱酸盐,并且酸式根电离程度小于水解程度,化学式可能是NaHCO3、NaHS等。

【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃