题目内容
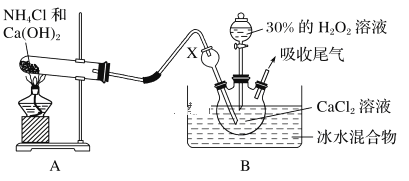
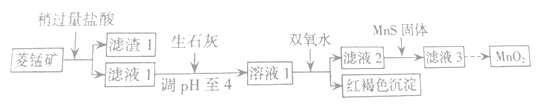
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的pH:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________;盐酸溶解MnCO3的离子方程式为___________;
(2)向溶液1中加入双氧水,反应的离子方程式是 ______________________________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- + ____ =______+ ____+ ____。
【答案】增大接触面积,加快反应速率 MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O 2Fe2+ + H2O2 + 4H2O=2Fe(OH)3↓+4H+ MnS + Cu2+ =CuS + Mn2+ 4H2O 5MnO2 Cl2 ↑ 8H+
【解析】
菱锰矿中加入过量的盐酸,SiO2不溶于盐酸,进入滤渣1,MnCO3、FeCO3、Cu2(OH)2CO3和盐酸反应生成MnCl2、FeCl2和CuCl2,在滤液1中。加入生石灰调节pH=4,再加入双氧水,把Fe2+氧化为Fe3+,在pH=4的溶液中Fe3+完全沉淀为Fe(OH)3而除去。向滤液中加入MnS,把铜离子沉淀除去。滤液经处理,最后得到MnO2。
(1)粉碎菱锰矿的主要目的是增大接触面积,加快反应速率;盐酸和MnCO3发生复分解反应,离子方程式为MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O。故答案为:增大接触面积,加快反应速率,MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O;
(2)向溶液1中加入双氧水的目的是把Fe2+氧化为Fe3+,在PH=4的溶液中Fe3+完全沉淀为Fe(OH)3,反应的离子方程式是2Fe2+ + H2O2 + 4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生沉淀的转化,反应的离子方程式为MnS + Cu2+ =CuS + Mn2+;
(4)用酸化的NaClO3溶液将MnCl2转化为MnO2,5molMn2+转化为MnO2失去10mol电子,2mol ClO3-也应得到10mol电子,所以ClO3-的还原产物中Cl的化合价为0价,即为Cl2。再根据电荷守恒和溶液呈酸性,需要生成H+,最后根据质量守恒,反应中有水参加。配平的离子方程式为:5Mn2+ + 2ClO3- + 4H2O=5MnO2+Cl2 ↑+8H+。故答案为:4H2O,5MnO2,Cl2 ↑,8H+。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
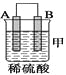
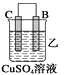
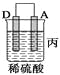
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。