题目内容
19.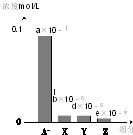 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
分析 一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
A.该混合液pH>7;B.Y表示HA,溶液中存在物料守恒得到c(A-)+c(Y)=c(Na+);C.HA为弱酸;D.X表示OH-,Y表示HA,Z表示H+.
解答 解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA).
A.所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,c(Na+)>c(A-),由电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),该混合液pH>7,故A错误;
B.溶液中存在物料守恒c(Na+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(Na+),故B正确;
C.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,故C错误;
D.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,故D错误;
故选B.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | IA族,单质的熔点逐渐降低 | |
| B. | ⅥA族,对气态氢化物还原性逐渐增强 | |
| C. | VA族氢化物的沸点逐渐升高 | |
| D. | ⅣA族最高氧化物对应水化物的酸性逐渐增强 |
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | abc 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A. | 当pH<4时,碳钢主要发生析氢腐蚀 | |
| B. | 当pH>6时,碳钢主要发生吸氧腐蚀 | |
| C. | 当pH>14时,正极反应为O2+4H++4e→2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 |
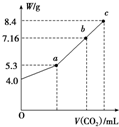
 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )| A. | 该反应平衡常数的表达式为K=c(H4SiO4) | |
| B. | 该生成H4SiO4的反应为吸热反应 | |
| C. | 用H4SiO4表示的反应速率为1.04×10-2mol/(L•h) | |
| D. | 若K值变大,在平衡移动时逆反应速率先减小后增大 |
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同素异形体 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm具有相同核外电子排布 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的性质完全相同 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质子数不同,但中子数相同 |
| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
| A. | 常温常压下,32g O2和16g O3的混合物中,含有O原子数目为2NA | |
| B. | 标准状况下,1mol Na2O 和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为 $\frac{2}{3}$NA |
 钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化.完成下列计算:
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化.完成下列计算: .
.