题目内容
4. 钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化.完成下列计算:
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化.完成下列计算:(1)将7.8克Na2O2完全溶解于93.8克水中,所得溶液的质量百分比浓度为8%
(2)将11.6克二氧化碳和水蒸汽的混合物与足量的Na2O2充分反应,固体质量增加了3.6克,则原混合气体的平均分子量为23.2.
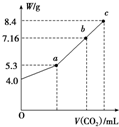
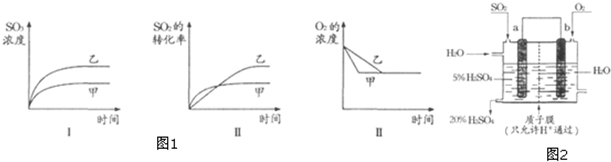
(3)向100mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水).通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示.
(a)推断b点时M的组成成份(写出计算过程).
(b)若向b点的盐溶液中只加入0.03mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO38.48g,则加入的物质可以是Na2O或Na2O2.
(4)由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成份.(已知NaHCO3的分解温度低于250℃)
分析 (1)过氧化钠与水反应生成氢氧化钠和氧气,溶质为氢氧化钠,溶液的质量为过氧化钠的质量加水的质量减去氧气的质量;
(2)CO2和水蒸气的混合物与足量的Na2O2充分反应,反应方程式分别为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2中固体质量增加的量相当于CO、2Na2O2+2H2O=4NaOH+O2↑中固体质量增加的量相当于H2,设二氧化碳、水蒸气的物质的量分别是xmol、ymol,根据二氧化碳和水蒸气质量、CO和氢气质量计算二者的物质的量,再根据$\overline{M}$=$\frac{m}{n}$计算原来混合气体的平均摩尔质量;
(3)(a)图b点时M的质量为7.16 g,5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成;
(b)结合C原子、Na原子守恒进行判断;
(4)加热发生反应:①NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,若碳酸氢钠过量,还发生反应:②NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,若NaOH、NaHCO3恰好按1:1反应,固体减少质量为水的质量,根据方程式可知,生成水的质量=31g×$\frac{18}{124}$=4.5g,实际固体质量减少(31-N) g,所以当(31-N) g≤4.5g,说明氢氧化钠过量只发生反应①,最终还剩NaOH和Na2CO3的混合物,当(31-N) g≥4.5g,说明氢氧化钠少量发生反应①和②,最终只剩Na2CO3,据此分析;
解答 解:(1)过氧化钠与水反应:
2Na2O2 +2H2O=4NaOH+O2↑
156 160 32
7.8g m(NaOH) m(O2) 解得:m(NaOH)=8g m(O2)=1.6g
溶液的溶质的质量分数:$\frac{8g}{7.8g+93.8g-1.6g}$×100%=8%;
故答案为:8%;
(2)CO2和水蒸气的混合物与足量的Na2O2充分反应,反应方程式分别为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2中固体质量增加的量相当于CO、2Na2O2+2H2O=4NaOH+O2↑中固体质量增加的量相当于H2,
设二氧化碳、水蒸气的物质的量分别是xmol、ymol,根据二氧化碳和水蒸气质量、CO和氢气质量得$\left\{\begin{array}{l}{44x+18y=11.6}\\{28x+2y=3.6}\end{array}\right.$,
解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.4}\end{array}\right.$,所以原来混合气体的物质的量=(0.1+0.4)mol=0.5mol,
原来混合气体平均摩尔质量$\overline{M}$=$\frac{m}{n}$=$\frac{11.6g}{0.5mol}$=23.2g/mol,故答案为:23.2;
(3)由图知NaOH质量为4 g,物质的量为0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol×$\frac{1}{2}$×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3,C点白色固体M为NaHCO3.
(a)图b点时M的质量为7.16 g,5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,故答案为:Na2CO3、NaHCO3;
(b)7.16 g盐为Na2CO3为0.02 mol,NaHCO3为0.06 mol.要得到纯净的8.48g Na2CO3固体,即要将0.06mol NaHCO3变为0.03 mol Na2CO3,
“某种物质”需满足3个条件:a.显碱性或能生成碱,b.需加入Na元素,c.不能带来其它杂质.
①中根据Na原子守恒,0.03 mol物质中需有0.06mol Na原子,故符合条件的只有Na2O或Na2O2,
故答案为:Na2O;Na2O2;
(4)由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃发生反应:①NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,若碳酸氢钠过量,还发生反应:②NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,若NaOH、NaHCO3恰好按1:1反应,固体减少质量为水的质量,根据方程式可知,生成水的质量=31g×$\frac{18}{124}$=4.5g,实际固体质量减少(31-N) g,所以当(31-N) g<4.5g,即N>26.5时说明氢氧化钠过量只发生反应①,最终还剩NaOH和Na2CO3的混合物,当(31-N) g≥4.5g,即N≤26.5时说明氢氧化钠少量发生反应①和②,最终只剩Na2CO3,答:N>26.5时,剩余固体为NaOH和Na2CO3的混合物;N≤26.5时,剩余固体为Na2CO3 .
点评 本题以钠及其化合物的性质以及图象形式考查化学计算,难度中等,抓住有关钠及其化合物之间的反应是解题关键,注意基本反应方程式的积累.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 二氧化硅是制造玻璃、光导纤维的原料 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | NOx、CO2、PM2.5颗粒都会导致酸雨 |
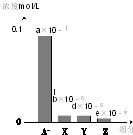 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
| A. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| B. | 石英玻璃、陶瓷都属于硅酸盐产品 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 牛油和花生油在碱性条件下水解产物相同 |
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方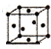 | a |
| Ⅱ | 体心立方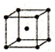 | b |
 .
. 或
或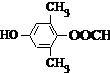 .
.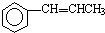 为原料制备
为原料制备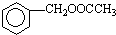 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.