题目内容
7.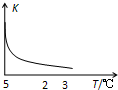 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )| A. | 该反应平衡常数的表达式为K=c(H4SiO4) | |
| B. | 该生成H4SiO4的反应为吸热反应 | |
| C. | 用H4SiO4表示的反应速率为1.04×10-2mol/(L•h) | |
| D. | 若K值变大,在平衡移动时逆反应速率先减小后增大 |
分析 A.根据平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积,主要纯液态和纯固体不列出;
B.根据图象得出平衡常数K随温度升高而减小,说明升温平衡向逆反应方向移动,据此判断;
C.根据v=$\frac{△c}{△t}$进行计算;
D.根据图象得出K值变大,则温度降低,所以正逆反应速率都先减小,但平衡又向正反应方向移动,所以正反应速率再变小而逆反应速率后增大.
解答 解:A.因为平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积,又SiO2为固体,H2O为纯液态,所以K=c(H4SiO4),故A正确;
B.由图象得出平衡常数K随温度升高而减小,说明升温平衡向逆反应方向移动,则逆反应为吸热反应,所以生成H4SiO4的正反应为放热反应,故B错误;
C.设体积为Vml,则搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),所以H4SiO4的浓度变化为$\frac{\frac{1.0g/mL×Vml×0.01%}{96g/mol}}{V×10{\;}^{-3}L}$=$\frac{1}{960}$mol/L,所以v=$\frac{△c}{△t}$=$\frac{\frac{1}{960}}{1}$=$\frac{1}{960}$=1.04×10-3mol/(L•h),故C错误;
D.由图象得出K值变大,则温度降低,所以正逆反应速率都先减小,但平衡又向正反应方向移动,所以正反应速率再变小而逆反应速率后增大,所以若K值变大,在平衡移动时逆反应速率先减小后增大,故D正确;
故选:AD.
点评 本题主要考查了平衡常数的表达式的书写、平衡常数与温度以及平衡移动的关系和反应速率的计算等,难度不大,注意平衡移动原理的应用等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列叙述中正确的是( )
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
| D. |  分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
18.下列有关实验操作的解释或纵论正确的是( )
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中溶液褪色,加热褪色后的溶液,溶液又恢复原色 | 该气体为SO2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
2.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )

| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
12.化学与人们的日常生活密切相关,下列叙述正确的是( )
| A. | 二氧化硅是制造玻璃、光导纤维的原料 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | NOx、CO2、PM2.5颗粒都会导致酸雨 |
19.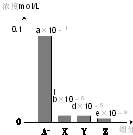 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
16.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
1.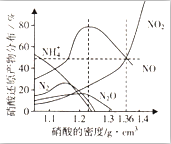 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
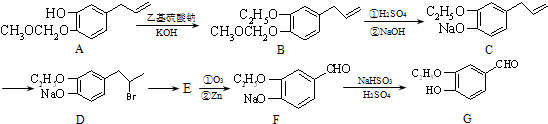
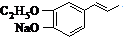 .
.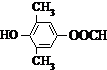 或
或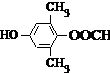 .
.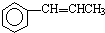 为原料制备
为原料制备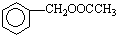 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.