题目内容
9.周期表中同族元素单质及其化合物在许多性质上都存在着递变规律,随着原子序数的递增,下列有关说法正确的是( )| A. | IA族,单质的熔点逐渐降低 | |
| B. | ⅥA族,对气态氢化物还原性逐渐增强 | |
| C. | VA族氢化物的沸点逐渐升高 | |
| D. | ⅣA族最高氧化物对应水化物的酸性逐渐增强 |
分析 A.第IA族包含H和碱金属;
B.元素的非金属性越强,则氢化物的还原性越弱;
C.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高;
D.同主族从上到下最高价氧化物的水化物的酸性减弱.
解答 解:A.第IA族包含H和碱金属,氢气常温下为气体,熔点很低,碱金属的熔点依次降低,故A错误;
B.元素的非金属性越强,则氢化物的还原性越弱,ⅥA族元素的非金属性依次减弱,所以对气态氢化物还原性逐渐增强,故B正确;
C.氢化物的相对分子质量越大,沸点越高,氨气分子间含有氢键沸点较高,所以VA族氢化物中氨气的沸点最高,故C错误;
D.同主族从上到下最高价氧化物的水化物的酸性减弱,则第ⅣA族最高氧化物对应水化物的酸性逐渐减弱,故D错误.
故选B.
点评 本题考查原子结构和元素周期律关系,明确同一周期、同一主族元素性质递变规律是解本题关键,注意规律中的反常现象,氨气、水和HF中都含有氢键,氢键只影响物质物理性质不影响化学性质.

练习册系列答案
相关题目
18.灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H=+2.1kJ/mol下列说法正确的是( )
| A. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 | |
| B. | 锡在常温下以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 灰锡和白锡的相互转化互为可逆反应 |
20.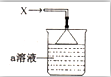 如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
 如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )| A. | 气体X易液化的原因是相对分子质量较大 | |
| B. | W溶液四种离子中两两结合所能形成的离子化合物有两种 | |
| C. | 若a溶液吸收一定量的气体X后,溶液pH=7,此时溶液中有4种溶质 | |
| D. | a溶液中由水电离出的c(H+)=10-13mol•L-1 |
17.下列叙述中正确的是( )
| A. | 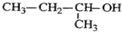 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
| D. | 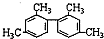 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
4.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下11.2L乙烯和丙烯的混合气体中含C-H键的数目为2NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| D. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
1.设NA代表阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 25℃时,pH=11的Na2CO3溶液中水电离出来的H+数目为10-3NA | |
| B. | 78gNa2S和Na2O2的混合物中阴离子的数目为2NA | |
| C. | 在标准状况下,11.2LCCI4分子中氯原子数目为2NA | |
| D. | 室温下,4.4g乙醛和乙酸乙酯的混合物中含有碳原子数目为0.2NA |
18.下列有关实验操作的解释或纵论正确的是( )
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中溶液褪色,加热褪色后的溶液,溶液又恢复原色 | 该气体为SO2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
19.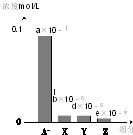 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |