题目内容
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是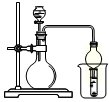
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
AB
解析试题分析:A.没有提供苯酚钠溶液无法对比,错误。B中生成少量醋酸不能挥发出去且盐酸可能会挥发也不行。C和D根据题目所提供的条件,可行。
考点:本题考查酸的挥发性实际结论的影响分析。

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
关于图中各装置的叙述不正确的是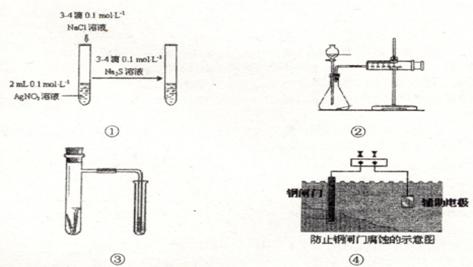
| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
下列不能达到实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
如图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是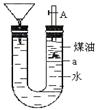
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
用下列实验装置进行的实验中,不能达到相应实验目的的是
| A.用图①所示实验装置排空气法收集H2气体 |
| B.图②装置可以用来验证化学能转化为电能 |
| C.图③铁片最终完全溶解,且高锰酸钾溶液褪色 |
| D.图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
下列实验方法正确的是
| A.除去NaCl溶液中的Cl2,可加入酒精后分液 |
| B.滴定管用蒸馏水洗净后,直接装入标准浓度的溶液滴定 |
| C.用排水法收集稀HNO3和Cu反应产生的NO气体 |
| D.用KSCN溶液和氯水鉴别FeCl3溶液中是否含有FeCl2 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是
( )。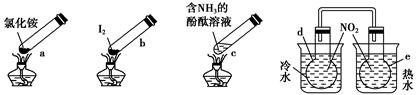
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |


